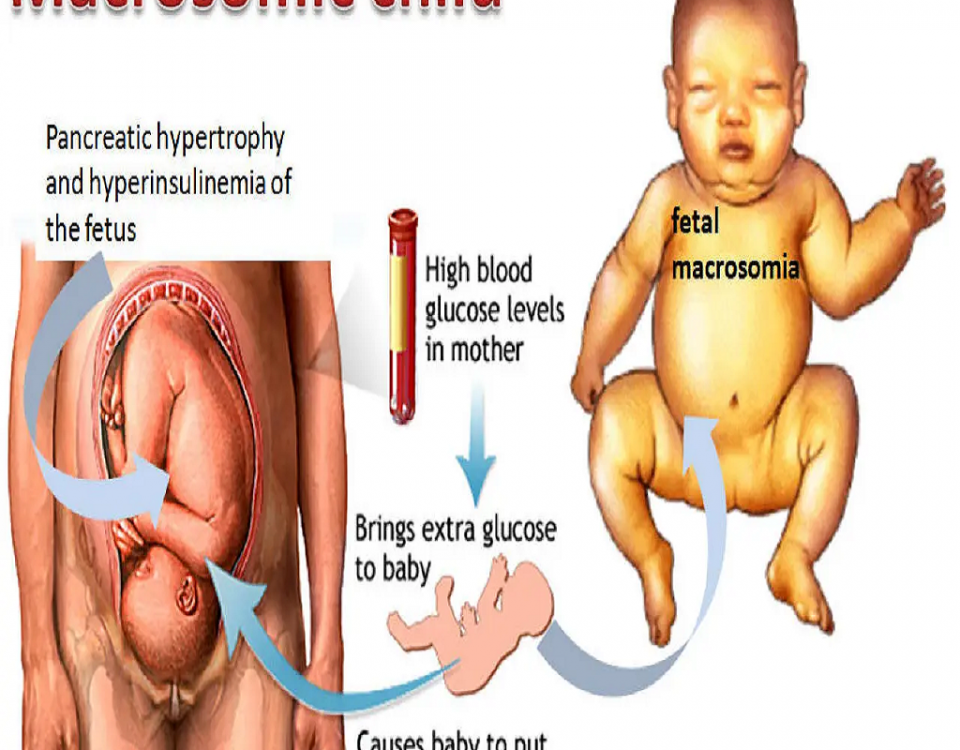
سندروم دیسترس تنفسی
بهمن ۷، ۱۴۰۲
تاکی پنه گذرای نوزادی
بهمن ۷، ۱۴۰۲عوارض سندروم دیسترس تنفسی و مراقبتهای ویژه
وخیم ترین عوارض انتوباسیون تراشه شامل پنوموتوراکس وسایرمواردنشت هوا، آسفیکسی(ناشی ازانسداد یاجابجائی لوله) برادیکاردی طی انتوباسیون یا ساکشن و بعدهاتنگی ساب گلوت میباشد. سایرعوارض عبارتنداز:خونریزی ناشی ازترومای انتوباسیون، دیورتیکول کاذب فارنکس خلفی، نیازبه تراکئوستومی، زخم منخرین (nares) ناشی ازفشارلوله، تنگی دائم سوراخ ها ی بینی به علت آسیب بافتی واسکارحاصله ازتحریک یا عفونت پیرامون لوله، اروزیون کام، کنده شدن طناب های صوتی، اولسرلارنکس، پاپیلوم طناب صوتی و خشونت دائمی صدا، استریدور و ادم لارنکس.
روش های کاهش شیوع این عوارض شامل این موارداست :انتوباسیون ماهرانه، تثبیت مناسب لوله، استفاده ازلولههای پولی وینیل برای انتوباسیون، استفاده از کوچک تر ین سایزلوله برای تهویه مناسب به منظوراجتناب ازنکروزوایسکمی فشاری، اجتناب ازتغییروحرکت مداوم لوله تراشه، اجتناب ازساکشن مکرروقوی و پیشگیری ازعفونت بارعایت بهداشت واستریلیزاسیون تمام وسایل مرتبط باانتوباسیون. پرسنلی که مسئول استقرارومراقبت ازلوله تراشه میباشد، بایدمجرب وماهرباشند.
خطرات ناشی ازکاتتریزاسیون شریان نافی شامل آمبولیزه شده عروق، ترومبوز، اسپاسم، پرفوراسیون رگ، نکروزشیمیائی یاایسکمی احشاء شکمی، عفونت، خونریزی اتفاقی، هیپرتانسیون ومختل شدن گردش خون پاوگانگرن آن است .طی آئورتوگرافی، لختههای خون درون یا پیرامون نوک کاتترهای شریان نافی در1% موارددیده شده است. به منظوربررسی ترومبوزمی توان ازسونوگرافی آئورت نیزاستفاده کرد. خطر عوارض مهم بالینی ناشی ازکاتترنافی احتمالابین 2% تا5% است.
بی رنگ شدن گذرای پا به هنگام کاتتریزاسیون شریان نافی، معمولاناشی ازاسپاسم رفلکسی شریان میباشد که بااستفاده ازکاتترکوچک تر، به خصوص درنوزادان بسیارکوچک، میتوان ازشیوع آن کاست. کاتترراباید به سرعت درآوردوسپس اقدام به کاتتریزاسیون شریان بعدی نمود. اسپاسم دائم رگ، حتی پس ازبیرون آوردن کاتتر رامی توان بامالیدن پمادتوپیکال نیتروگلیسیرین روی ناحیه مبتلاو به ندرت نیزباگرم کردن عضو مقابل، درمان کرد. اسپاسم یاترومبوزمقاوم به درمان میتواندمنجربه گانگرن عضویاناحیه مشروب توسط همان رگ شود.
خونریزی شدید به دنبال درآوردن کاتتر، نادراست. شریان یاکاتترممکن است دچارترومبوزشودکه شیوع آن رامی توان بامصرف کاتترهای بانوک نرم که تنهادرنوک خوددارای سوراخ هستند، شستشوی کاتتربااندکی محلول سالین حاوی هپارین، یا باانفوزیون مداوم محلول حاوی 1-2 units/mL هپارین کاهش داد. خطر تشکیل ترومبوزواحتمال انسدادعروقی رانیزمی توان با درآوردن کاتتر به هنگامی که اولین نشانههای ترومبوزدیده شود(مثل ضعیف شدن فشارنبض و محوشدن فرورفتگی دیکورتیک نبض) کاهش داد. برخی متخصصین ترجیح میدهندکه ازشریان نافی تنهاجهت نمونه گیری خون استفاده نموده وکاتتررابین نمونه گیری ها بامحلول سالین هپارینزه پرکنند. هیپرتانسیون رنوواسکولار روزهاتاهفتهها بعدازکاتتریزاسیون شریان نافی دراندکی ازنوزادان دیده میشود. خطرات ناشی ازکاتتریزاسیون ورید نافی نظیرشریان نافی است. سایرخطرات آن عبارتنداز:پرفوراسیون قلبی وتامپونادپریکارد( زمانی رخ میدهدکه کاتتربه اشتباه درون دهلیزراست مستقرگردد) و هیپرتانسیون پورتال ( ناشی از ترومبوزوریدپورت) به خصوص درحضورامفالیت.
نشت هوا به خارج ریه ازعوارض شایع مراقبت ازنوزادان مبتلابه RDS میباشد. برخی نوزادان مبتلابه RDS، دچارشنت مهم بالینی ازمسیر PDA میباشند. تاخیردربسته شدن PDA بدنبال هیپوکسی، اسیدوز، افزایش فشارپولمونرناشی ازانقباض عروق، هیپوتانسیون سیستمیک، نارسی و ترشح موضعی پروستاگلاندین (که سبب اتساع داکتوس میشود) دیده می شود. شنت PDA درابتداممکن است دوطرفه یاراست به چپ باشد. بابهبودی RDS، مقدارPVR کاهش یافته وشنت چپ به راست رخ میدهدکه حاصل آن افزایش حجم بطن چپ وادم ریوی است.
تظاهرات PDA عبارتنداز:1) پره کوردفعال، نبضهای محیطی جهنده، فشارنبض پهن و سوفل سیستولیک یا مداوم همراه یابدون گسترش به دیاستول یا سوفل دیاستولیک اپیکال، یا کلیک متعدد شبیه لرزش، 2) شواهدرادیوگرافیک کاردیومگالی وافزایش عروق ریوی، 3) هپاتومگالی، 4) افزایش وابستگی به اکسیژن و 5) احتباس دی اکسیدکربن.
تشخیص بامشاهده اکوکاردیوگرافیک PDA میباشدوشنت چپ به راست یا دوطرفه باداپلردیده می شود. سه راهکار مراقبت از PDA عبارت است از:بستن پروفیلاکتیک مجراقبل ازبروزعلائم ونشانههای بیماری، بستن مجرای فاقد علامت اما شناخته شده بالینی و بستن PDA سمپتوماتیک. اقدامات درمانی شامل محدودیت مایع، مصرف مهارکنندههای سیکلواکسیژناز( ایندو متاسین یا بروفن) به منظوربستن مجرا و بستن باجراحی است. مزایای کوتاه مدت ایندومتاسین راباید باعوارض آن، شامل اختلال گذرای کارکلیه وافزایش احتمالی خطر پرفوراسیون روده، مقایسه کرد. هنوزهم راجع به ” بهترین روش کار” برای مراقبت از PDA مباحثی وجوددارد. بسیاری ازبیماران به اقدامات نگهدارنده، شامل محدودیت مایع، پاسخ میدهند. بستن طبی یاجراحی درنوزادان پره ماچورمبتلابه PDA بزرگ، زمانی که بهبودی بالینی نوزاد به تاخیرافتاده ویاوضعیت نوزاد به دنبال بهبودی اولیه بالینی RDS روبه وخامت گذاشته باشد، توصیه میشود. ایندومتاسین وریدی (0. 1-0. 2 mg/kg/dose ) درسه دوزهر24-12 ساعت تجویزمی شود، که میتوان یکباردیگرآن راتکرارکرد. درمعدودی بیماران علامت دار ممکن است به تکرارتجویز ایندومتاسین نیازباشد. درصورت عدم بسته شدن مجرادرنوزاد علامت دار ، معمولاتوصیه به لیگاسیون جراحی میشود. تجویزپروفیلاکتیک ایندومتاسین بادوزپائین پس ازتولد، ازشیوع IVH و PDAکاسته وشانس بسته شدن مجرای بازراحتی درنارس ترین نوزادان، افزایش میدهد. ممنوعیت مصرف ایندومتاسین عبارت است از :ترومبوسیتوپنی (<50,000 platelets/mm3) اختلالات خونریزی دهنده، اولیگوری ( <1mL/kg/hr) ، NEC، پرفوراسیون ایزوله روده و افزایش سطح کراتینین خون(>1. 8 mg/dL). اندیکاسیون جراحی شامل PDA علامت دار مقاوم به ایندومتاسین ویا ممنوعیت مصرف آن میباشد. مورتالیتی جراحی حتی درنوزادان به شدت LBW، بسیارپائین است. عوارض جراحی شامل این موارداست : سندروم هورنر، آسیب عصب رکورنت لارنژیال، شیلوتوراکس، هیپرتانسیون گذرا، پنوموتوراکس و خونریزی ازمحل جراحی. لیگاسیون ناخواسته شریان پولمونرچپ یا قوس عرضی آئورت نیزگزارش شده است. ایبوبروفن وریدی میتواند جانشین ایندومتاسین شود. این داروبطورموثری باعث بسته شدن PDA شده و لی سبب کاهش سرعت جریان خون مغزی، مزانتریک، یا کلیوی نمی شود. بروفن درمقایسه با ایندومتاسین کمترسبب اولیگوری میشود.
دیسپلازی برونکوپولمونر(BPD) ناشی ازآسیب ریه درنوزادانی رخ می دهد که نیازبه تهویه مکانیکی واکسیژن اضافی دارند. مشخصات بالینی، رادیوگرافیک و هیستولوژی ریه در BPD کلاسیک درسال 1967، یعنی قبل ازمصرف گسترده استروئیدآنته ناتال و سورفاکتانت پست ناتال، توصیف شده است. بیماری درنوزادان پرهترم رسیده ترکه مبتلابه RDS بوده وتحت درمان تهویه بافشارمثبت واکسیژن بودند، دیده میشد. امروزه BPD اصولابیماری نوزادان باوزن زیر1000 گرم باسن بارداری کمتراز28 هفته است، که برخی ازاین نوزادان دربدوتولد فاقد بیماری ریوی ویادچارنوع خفیف آن بوده ولی طی هفته اول دچارنارسائی تنفسی پیشرونده میشوند. تغییرات مشهوددر BPDامروزه شامل هیپوپلازی آلوئولار، فیبروزمتغییردیواره ساکولار و بیماری جزئی( مینیمال) مجاری هوائی است. دربرخی نمونه هانیزکاهش رشد عروق میکروسکوپیک ریه دیده شده است. هیستوپاتولوژی BPD بیانگراختلال دربلوغ آناتومیک نرمال ریه است که میتواندمانع ازرشدوتکامل بعدی ریه شود. پاتوژنز BPDمولتی فاکتوریال وموثربرریه و قلب میباشد. RDSنوعی بیماری با کولاپس پیشرونده آلوئولارمی باشد. کولاپس آلوئول (atelectotrauma) ناشی ازکمبودسورفاکتانت، توام با بیش اتساعی حاصله ازونتیلاتور(volutrauma) سبب پیشرفت بیماری میشود. اکسیژن با رهاسازی رادیکال ها یآزاداکسیژن، که سیستم آنتی اکسیدان نارس درنوزادان VLBW توانائی مقابله باآن راندارد، نیزسبب آسیب ریه میشود. تهویه مکانیکی واکسیژن ازطریق تاثیربرتکامل آلوئول وعروق ریه سبب آسیب رسانیدن به ریه میشوند. التهاب ( که بابررسی نوتروفیل ها ی خون محیطی، نوتروفیلها وماکروفاژهای مایع آلوئولی و سیتوکینهای پیش التهابی قابل شناسائی است) درپیشرفت آسیب ریه دخالت دارد. فاکتورهای بالینی متعددی شامل نارسی، کوریوآمنیونیت، عفونت، PDAسمپتوماتیک وسوء تغذیه درایجادBPD دخالت دارند. بروزBPD رابطه معکوس باسن بارداری دارد. سایرفاکتورهایی که بابیماری همراهی دارندعبارتنداز:وجودآمفیزم انترستیسیل، جنس پسر، Paco2 پائین طی درمان RDS، PDA، فشاردمی بالا، افزایش مقاومت مجرای هوائی دراولین هفته زندگی، افزایش فشارشریان ریوی و احتمالا سابقه خانوادگی اتوپی یا آسم.
پولی مورفیسم ژنتیک ممکن است سبب افزایش خطر بروز BPDشود. دربرخی نوزادان VLBW بدون ابتلاء به RDS، که نیازمندتهویه مکانیکی جهت آپنه یانارسائی تنفسی هستند، BPDبدون الگوی کلاسیک تظاهرمی کند. هیدراسیون مفرط نوزادطی اولین روزهای تولدممکن است درایجاد BPD دخالت داشته باشد. مصرف مکمل ویتامین A(5,000 IU عضلانی 3 باردرهفته برای 4 هفته) در نوزادان VLBW سبب کاهش BPD میشود(پیشگیری از1 موردبه ازای درمان هر15-14 نوزاد). استفاده زودرس ازنازال CPAP واکستوباسیون سریع وسپس استفاده ازنازال CPAP، باکاهش خطر BPD همراه بوده است.
برخی نوزادان به جای بهبودی درروزهای سوم یاچهارم، که مطابق سیرطبیعی RDS است، نیازبه افزایش اکسیژن و حمایت ونتیلاتورپیدامی کنند. دیسترس تنفسی ادامه یافته ویاوضع آن بدترشده که مشخصه آن هیپوکسی، هیپرکاپنه ،وابستگی به اکسیژن و درمواردشدید،نارسائی قلب راست میباشد. آمفیزم انترستیس ریه، آتلکتازی سرگردان با پرهوائی توامان و تشکیل کیست ازیافتههای رادیوگرافیک آن است (شکل 1.6). چهارمرحله پاتولوژیک مشخص برای BPD کلاسیک شناسائی شده است : آسیب حادریه، برونشیولیت اگزوداتیو، برونشیولیت پرولیفراتیو، وبرونشیولیت فیبروپرولیفراتیو انسدادی. مطالعه هیستولوژیک دراین مرحله (روزهای 20-10) نشان دهنده بقایای تشکیل غشاء هیالین، درهم رفتن پیشرونده آلوئولی همراه باآتلکتازی آلوئول ها ی مجاور، ادم انترستیس، ضخیم شدن خشن موضعی غشاء پایه و هیپرپلازی ومتاپلازی گسترده مخاط برونش وبرونشیول است. این یافته هامطابق باتوزیع به شدت نامناسب تهویه میباشد. معاینه پاتولوژیک نوزادانی که درسیربیماری BPD فوت شدهاند، بیانگربزرگی قلب وتغییرات ریوی شامل نواحی فوکال آمفیزم همراه باهیپرتروفی عضله صاف اطراف برونشهای انشعابی، فیبروزاطراف مخاط، متاپلازی وسیع مخاط برونشیول، ضخیم شدن غشاء پایه و جداشدن مویرگ ها از سلول های اپی تلیال آلوئولی است.

شکل 1.6 : تغییرات ریوی درنوزادان تحت درمان بافشارمثبت متناوب طولانی، که بلافاصله پس ازتولد به علت سندروم بالینی بیماری غشاء هیالین ازهوائی بااکسیژن 100-80% استنشاق نموده اند. A :نوزاد 5 روزه با کدورت تقریبا کامل ریه ها. B: نوزاد13 روزه با ” ریههای حبابی ” شبیه نمای رادیوگرافیک سندروم ویلسون – میکیتی. C: نوزاد 7 روزه بانمای نوارهای نامنظم ودانس درهردوریه و پرهوائی وکاردیومگالی که بیانگربیماری مزمن ریه است. D :بطن راست بزرگ وریه هوادارنامنظم وصلهای دریک نوزادکه در11ماهگی فوت شده است. این نوزادهمچنین دچارPDA بود.
BPD رامی توان براساس نیازبه اکسیژن اضافه طبقه بندی نمود(جدول 1.2). نوزادتحت حمایت بااکسیژن بافشارمثبت یا درحال دریافت≥30% اکسیژن اضافی درهفته 36 یا به هنگام ترخیص (هرکدام زودترباشد) به عنوان بیماری BPDشدید شناخته میشود. آنهائی که نیازبه اکسیژن 29-22% دراین سن دارند را به عنوان BPD متوسط میشناسند. بیمارانی که بیش از28روزنیازمنداکسیژن بوده ولی درسن 36 هفتگی یا به هنگام ترخیص ازهوای اتاق تنفس میکنند، BPD خفیف خوانده میشوند. نوزادانی که اکسیژن مصرفی آنها <30% میباشد رامیتوان تحت نظارت کامل ومراقبت ازاشباع اکسیژن، بطورمرحلهای هربار2% ازاکسیژن دریافتی آنها راکم کردتا زمانی که به هوای اتاق برسند. این تست به شدت قابل اطمینان بوده وارتباط مستقیم باترخیص نوزادروی مصرف اکسیژن (درمنزل) ،طول مدت بستری دربیمارستان و بستری مجدددراولین سال زندگی دارد.
جدول1.2:تعریف دیسپلازی برونکوپولمونر:معیارهای تشخیصی *
|
|||||||||||||||
| * BPDمعمولادرنوزادی ایجادمی شودکه تحت درمان بااکسیژن و PPVبخاطرنارسائی تنفسی، اکثراسندروم دیسترس تنفسی، بوده است. تداوم ویژگی های بالینی بیماری تنفسی ( تاکی پنه، رتراکسیون، کراکل) درطیف وسیع BPD مشترک بوده و درمعیارهای تشخیصی ( که شدت BPD راتوصیف میکند) مدنظرنمی باشد. نوزادان تحت درمان >21% اکسیژن ویا PPV جهت بیماری های غیرتنفسی (مثل آپنه مرکزی یا فلج دیافراگم) دچار BPD نمی شوندمگرآنکه بیماری پارانشیم ریه درآنهاایجادشده وعلائم بالینی دیسترس تنفسی بروزکند. یک روزدرمان با اکسیژن> 21% به معنی دریافت اکسیژن > 21% برای بیش از12 ساعت درهمانروزاست. درمان بااکسیژن > 21% ویا PPV درهفته 36 پس ازقاعدگی یا درروز56 پس ازتولدیازمان ترخیص، نبایدبیانگریک حادثه ” حاد” باشد بلکه بیانگر درمان متعارف روزانه نوزادبه مدت چندروزقبل وبعدازهفته 36 پس ازقاعدگی، روز56 پس ازتولد، یازمان ترخیص میباشد.
**تست فیزیولوژیک موردنیازجهت بررسی نیازبه اکسیژن، هنوزمشخص نشده است. این بررسی میتواندشامل طیف اشباع پالس اکسیمتری باشد. |
BPD شدید نیازمندتهویه مکانیکی طولانی است. صرف نظرازبالارفتن Paco2 باید به تدریج بیمارراازدستگاه جداساخت، زیرا هیپرکاپنه ممکن است حاصل احتباس گازباشدونه تهویه ناکافی. گازهای خونی قابل قبول شامل هیپرکاپنه و >7. 20 pH و Pao2 of 50-70 mm Hgواشباع اکسیژن 1-88% میباشد. مقادیرکمتر Pao2 میتواندسبب بروزهیپرتانسیون پولمونروسرانجام کورپولمونل شود، بنابراین حدتحتانی اکسیژناسیون مطلوب درنوزادان مبتلابه BPD بالاترازنوزادان مبتلابه RDS میباشد. انسدادمجاری هوائی در BPD ناشی ازتولیدادم یا موکوس، برونکواسپاسم و کولاپس مجاری ناشی ازتراکئوبرونکومالاسی اکتسابی میباشد. این حوادث همچنین در” حملات سیانوز[blue spells]” دخالت دارند.حملات سیانوزمی تواندناشی ازوازواسپاسم حادریوی یا اختلال عملکردبطن راست باشد.
درمان BPD شامل حمایت تغذیهای، محدودیت مایع، دارو، حفظ اکسیژناسیون کافی و درمان به موقع عفونت است. رشد نوزادباید تحت کنترل باشد زیرابهبودبیماری بستگی به رشد بافت ریه و بازسازی بسترعروقی ریه دارد.
برای رشدنیازبه کالری اضافی (فورمولا با 24–30 calories/30 mL)، پروتئین( 3–3. 5 g/kg/24 hr) و چربی ( 3g/kg/24 hr) میباشد. دیورتیک، می تواند سبب بهبودی کوتاه مدت درمکانیک ریه ولذاکاهش نیازبه اکسیژن وونتیلاتورشود. لازیکس (1 mg/kg/dose وریدی روزی دوبار یا 2 mg/kg/dose خوراکی روزی دوبار) درمان انتخابی برای اضافه حجم حادمایع درنوزادان مبتلا به BPD میباشد. دیده شده است که این دیورتیک لوپ سبب کاهش آمفیزم انترستیس ریه (PIE) و PVR، بهبودعملکردریه و کمک به جداسازی بیمارازتهویه مکانیکی و اکسیژن میشود. عوارض جانبی ناشی ازمصرف طولانی داروشایع وشامل هیپوکالمی، هیپوناترمی، الکالوز، ازوتمی، هیپوکلسمی، هیپرکلسیوری، کوله لیتیاز، سنگ کلیه، نفرکلسینوز و اتوتوکسیسیته میباشد. تجویزکلریدپتاسیم اغلب موردنیازاست. هیپوناترمی رابایدبامحدودیت مایع وکاهش دوزیادفعات مصرف فورزوماید درمان کرد. ازمصرف کلریدسدیم بایداجتناب نمود. دیورتیک های تیازیدهمراه بامهارکننده آلدوسترون درنوزادمبتلابه BPD استفاده شده است. بررسیهای متعددی درموردمصرف دیورتیک تیازیدتوام با اسپیرونولاکتون درنوزادان مبتلابه BPD، نشان دهنده افزایش برونده ادراری بایابدون بهبودی درمکانیک ریه بوده است. عوارض جانبی شامل اختلال الکترولیت است. برونکودیلاتورهای استنشاقی باکاهش مقاومت مجاری هوائی سبب بهبودمکانیک ریه میشوند. آلبوترول یک آگونیست اختصاصی بتا2 میباشدکه برای درمان برونکواسپاسم در BPD استفاده شده است. آلبوترول میتواندباکاهش مقاومت مجاری تنفسی، ثانویه به شل شدن عضلات صاف، سبب بهبودکمپلیانس ریه شود. تغییرات مکانیک ریه 6-4 ساعت طول می کشد. عوارض جانبی شامل هیپرتانسیون وتاکیکاردی است. ایپراتروپیوم برومید، یک آنتاگونیست موسکارینیک وابسته به آتروپین ولی با خاصیت برونکودیلاتور قویتراست. بااستنشاق ایپراتروپیوم برومید، بهبودمکانیک ریه در BPD دیده شده است. درمان ترکیبی به کمک آلبوترول وایپراتروپیوم برومیدمی تواندموثرترازمصرف هریک به تنهائی باشد. عوارض جانبی معدودی گزارش شده است. از آنجائی که روش تجویزبصورت آئروسل است، دقیقامشخص نیست که چه مقدارداروبه مجاری تنفسی وریههای نوزادان مبتلابه BPD، بویژه اگرتحت ونتیلاتورباشند، میرسد. چون به نظر نمی رسد که ریلاکسشن شدیدعضله صاف دراولین هفتههای زندگی رخ دهد، بنابراین درمان آئروسل دراولین مراحل BPD توصیه نمی شود. ازمتیل گزانتین هابرای افزایش تحریک تنفسی، کاهش آپنه و بهبودانقباض دیافراگم استفاده شده است. متیل گزانتین هاهمچنین سبب کاهش PVR وافزایش کمپلیانس ریه در BPD، احتمالابواسطه تاثیرمستقیم ریلاکسشن عضلانی میشود. این گروه از داروهاهمچنین خاصیت دیورتیک دارد. این اثرات میتواندبه جداسازی سریع تر بیمارازونتیلاتورکمک کند. سینرژی بین تئوفیلین و دیورتیک های دیده شده است. نیمه عمرتئوفیلین 40-30 ساعت است. دارودرون کبدبه کافئین متابولیزه شده وممکن است عوارضی همچون تاکیکاردی، رفلاکس گوارشی، تحریک پذیری و تشنج داشته باشد. نیمه عمرکافئین طولانی ترازتئوفیلین است. هردونوع بصورت وریدی و خوراکی موجودهستند.
درمان پیشگیرانه از BPD باتجویزپست ناتال دگزامتازون میتواند زمان اکستوباسیون راکاهش داده و خطر BPD راکم کند، اماعوارض جانبی متعددکوتاه ودرازمدت داردکه شاملندبر :هیپرتانسیون، هیپرگلیسمی، خونریزی وپرفوراسیون گوارشی، کاردیومیوپاتی هیپرتروفیک، سپسیس و افزایش ضعیف دروزن ودورسر.
بقاء این بیماران بهترنشده ومصرف دگزامتازون سبب افزایش خطر تاخیرتکامل عصبی وفلج مغزی میشود. بنابراین برای پیگشیری از BPD، مصرف دگزامتازون هرگزتوصیه نمی شودمگرآنکه نوزاد دچاربیماری شدید ریوی، مثلا وابستگی به ونتیلاتوربرای دست کم 2-1 هفته پس ازتولد، باشد. یک دوره درمان باکاهش سریع دوز، بادوزاولیه 0. 25 mg/kg/day برای 7-5 روز کافی است . بکلومتازون استنشاقی سبب پیشگیری از BPD نشده، امانیازبه کورتون سیستمیک راکاهش میدهد. استروئیداستنشاقی به اکستوباسیون سریع تر نوزادمبتلابه BPD کمک میکند. ناهنجاری های فیزیولوژیک گردش خون ریه در BPD شامل افزایش PVR وپاسخ غیرنرمال عروق است. هیپوکسمی حاد حتی درمقادیراندک سبب افزایش شدیدفشارشریان ریوی دربیماران BPD میشود. مقادیربالای اشباع اکسیژن درکاهش فشارشریان ریوی موثر است. توصیه کنونی برای درمان نوزادان مبتلابه BPD وهیپرتانسیون پولمونر، اجتناب ازاشباع اکسیژن کمتراز88% و درصورت تثبیت شدن هیپرتانسیون پولمونر، حفظ اشباع اکسیژن درحد1-90% میباشد. دوزهای اندک iNO هیچگونه تاثیرحادی برعملکردریه، عملکردقلب، یااکسیژناسیون در BPDنداردولی دوزهای اندک آن میتوانددربرخی ازنوزادان مبتلابه BPD شدید، باعث بهبودی دراکسیژناسیون ولذاکاهش Fio2 وحمایت ونتیلاتورشود.