آپنه نوزادی
بهمن ۶، ۱۴۰۲
عوارض سندروم دیسترس تنفسی
بهمن ۷، ۱۴۰۲سندروم دیسترس تنفسی (بیماری غشاء هیالین)
شیوع
سندروم دیسترس تنفسی اصولادرنوزادان پره ماچوردیده میشود. شیوع آن رابطه معکوس با سن بارداری ووزن تولددارد. اختلال در80-60% نوزادان <28 wk، در30-15% نوزادان بین 32 و36 هفته و به ندرت درنوزادان >37 wk دیده میشود. خطر بروز RDS در این موارد افزایش مییابد :دیابت مادری، چندزائی، سزارین، زایمان فوری، آسفیکسی، استرس ناشی ازسرما و سابقه نوزادمبتلادرخانواده. شیوع بیماری در پره ترم ها ی پسریا سفیدپوست، بیشتراست. خطر RDS درمواردزیرکاهش مییابد:حاملگی توام با هیپرتانسیون مزمن یا وابسته به بارداری، مصرف هروئین درمادر، پارگی طولانی مدت غشاء و پروفیلاکسی آنته ناتال باکورتیکواستروئید.
اتیولوژی وپاتوفیزیولوژی
علت اصلی RDS، کمبودسورفاکتانت (کاهش تولیدوترشح) میباشد. عدم رسیدن به FRC کافی و تمایل ریه هابه آتلکتازی، رابطه نزدیک با کشش سطحی بالاو فقدان سورفاکتانت ریوی دارد. اجزاء اصلی سورفاکتانت عبارتنداز:لستین ( دی پالمیتویل فسفاتیدیل کولین) فسفاتیدیل گلیسرول، اپوپروتئین ها(پروتئینهای سورفاکتانت SP-A، SP-B، SP-C، و SP-D) وکسترول (شکل 1.2). باافزایش سن بارداری، مقایربیشتری ازفسفولیپیدهاسنتزشده ودر سلول های آلوئولار تیپ 2 ذخیره میشود(شکل 1.3). این عوامل فعال سطحی، به داخل آلوئول ها ترشح شده وسبب کاهش کشش سطحی و حفظ ثبات آلوئول، باجلوگیری ازکولاپس م جاری کم هوائی درانتهای بازدم، میشوند. مقادیرتولیدشده وترشح شده در نوزادان نارس ممکن است نیازهای پست – ناتال راتامین نکند. سورفاکتانت به مقدارزیاددرعصاره ریه جنین 20 هفته دیده میشود و لی تامدت هابعدبه سطح ریه نمی رسد. بین هفتههای 28 و32 درمایع آمنیوتیک وجوددارد. مقادیرکامل سورفاکتانت ریوی معمولا پس ازهفته 35 دیده میشود. اختلالات ژنتیک، هرچندکه نادرهستند، دردیسترس تنفسی دخالت دارند. ناهنجاری های ژن پروتئین سورفاکتانت B و C وهمچنین ژن مسئول انتقال سورفاکتانت ازغشاء (ABC transporter 3 [ABCA3]) سبب بیماری تنفسی فامیلیال شدیدوگاه کشنده میشود. سایر علت ها ی دیسترس تنفسی نوزادی (غیر RDS ) شامل است بر: دیسپلازی مویرگی آلوئولی، دیسپلازی آسینار، لنفانژکتازی ریوی و موکوپولی ساکاریدوز.
شکل 1.2: ترکیب سورفاکتانت حاصله ازشستشوی آلوئول. مقداراجزاء مختلف سورفاکتانت حاصله ازریه بالغ پستانداران، یکسان است (SP, surfactant protein).

شکل 1.3 :A : ریه جنین موش خرما(بزرگنمائی کوچک) روز20 (ترم، روز22) که نشان دهنده تشکیل سلول های تیپ 2، ذخیره گلیکوژن (نواحی کمرنگ) اجسام لاملارترشحی و میلین توبولاراست. B: مسیراحتمالی برای انتقال، ترشح و برداشت سورفاکتانت.

( ER, endoplasmic reticulum; GZ, Golgi zone; LMF, lattice (tubular) myelin figure; MLB, mature lamellar body; MVB, multivesicular body; N, nucleus; SLB, small lamellar body).
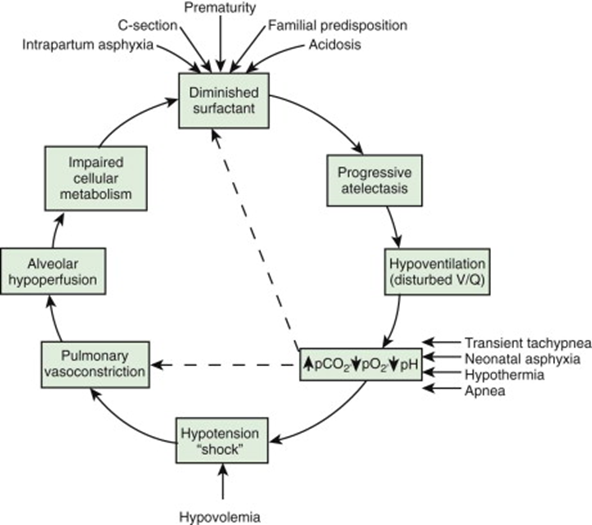
سنتزسورفاکتانت تاحدی بستگی به pH نرمال، دما و پرفوزیون دارد. علت ها ی کاهش سنتزسورفاکتانت شامل آسفیکسی، هیپوکسمی و ایسکمی ریوی (بویژه توام با هیپوولومی، هیپوتانسیون و استرس سرد) است. سلول اپی تلیال ریه تحت تاثیرغلظت بالای اکسیژن واثرات تهویه مصنوعی ممکن است آسیب دیده وسبب کاهش بیشترسورفاکتانت شود. آتلکتازی آلوئولی، تشکیل غشاء هیالین و ادم انترستیس باعث کاهش کملپیانس ریه در RDSشده وبنابراین برای اتساع آلوئول ها وم جاری کم هوائی نیازبه فشاربیشتری است. درنوزادمبتلا، بخش تحتانی دیواره سینه همزمان باپائین رفتن دیافراگم به داخل کشیده شده وفشاراینتراتوراسیک منفی میشود، بدین گونه مقدارفشاری که داخل توراکس تولیدمی شودکمترمی شود. نتیجه آن نیزبروزآتلکتازی است. دیواره سینه نوزادان پرهترم، که کمپلیانس بالائی دارد، درمقایسه بانوزادان ترم، مقاومت کمتری دربرابرتمایل طبیعی ریهها برای کولاپس دارد. بنابراین درانتهای بازدم، حجم توراکس وریهها به حجم باقیمانده رسیده وآتلکتازی رخ میدهد. نقص درسنتزیاترشح سورفاکتانت، توام با واحدهای تنفسی کوچک و دیواره سفت سینه، منجربه آتلکتازی وایجاد آلوئول ها ئی میشودکه پرفوزیون گشته ولی تهویه نمی شوند. حاصل این پدیده نیزبروزهیپوکسی است. ازطرفی دیگرکاهش کمپلیانس ریه، حجم جاری کم، افزایش فضای مرده فیزیولوژیک و تهویه ناکافی آلوئولی عملامنجربه هیپرکاپنه خواهدشد. ترکیبی ازهیپرکاپنه، هیپوکسی و اسیدوزباعث انقباض شریان های ریوی وافزایش شنت راست به چپ ازطریق فورامن اوال و داکتوس آرتریوزوس ودرون خودریه خواهدشد. بنابراین جریان خون ریه کاهش یافته وآسیب ایسکمیک سلول های مولدسورفاکتانت و بسترعروقی باعث نشت موادپروتئینی به داخل فضاهای آلوئولی میشود(شکل 1.4).
شکل 1.4 : فاکتورهای دخیل درپاتوژنزبیماری غشاء هیالین. سیکل ناقص بالقوه، باعث ایجادهیپوکسی و نارسائی ریوی میشود.
تظاهرات بالینی
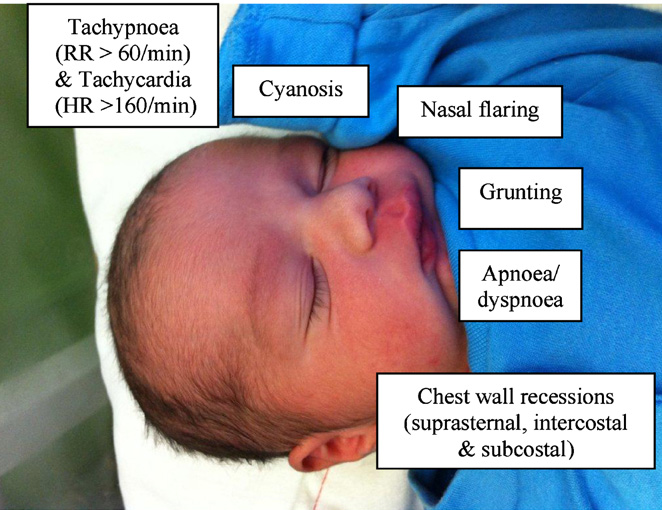
نشانههای RDS معمولا دقایقی بعدازتولدآشکارمی شود. هرچندکه درنوزادان پره ماچورکه بزرگ ترهستند ممکن است ساعت ها بعد، بصورت تنفس سریع وکوتاه تا60 breaths/min یابیشترآشکارمی شود. تاکی پنه باشروع تاخیری، مطرح کننده سایرعلل است. برخی بیماران به علت آسفیکسی اینتراپارتوم یادیسترس تنفسی شدید اولیه ( به خصوص دروزن تولد < 1,000 g ) نیازمنداحیاء دربدوتولدهستند. تاکی پنه، گرانتینگ بارز(اغلب قابل شنیدن) رتراکسیون اینترکوستال وساب کوستال، فلارینگ بینی و سیانوزدیده میشود. صداهای ریه ممکن است نرمال ویا کاهش یافته باکیفیت توبولاروخشن باشد، دردم عمیق، رال های ظریف به خصوص درناحیه خلف وقاعده ریه هاقابل سمع است. سیرطبیعی RDS درصورت عدم درمان، بصورت سیانوزودیسپنه پیشرونده است. درصورت عدم درمان مناسب، فشارخون کاهش یافته وبابدترشدن وضعیت، سیانوزورنگ پریدگی شدیدترشده وگرانتینگ کاهش یافته یامحومی شود. آپنه وتنفس نامنظم، نشانههای وخیم بیماری است که نیازبه مداخله فوری دارد. بیمارهمچنین ممکن است دچار اسیدوزمیکس تنفسی – متابولیک، ادم، اولیگوری وایلئوس گردد. نارسائی تنفسی درپیشرفت سریع بیماری دیده میشود. دراکثرموارد، علائم ونشانههای بیماری طی 3 روزبه ماکزیمم رسیده وپس ازآن، بهبودی تدریجی حاصل میشود. علائم بهبودی اغلب بصورت دیورزخودبخودی، بهبودگازهای خون نوزادباسطوح پائین تراکسیژن دمی و یا حمایت کمترونتیلاتورمی باشد. علت مرگ میتوانداختلال شدید درتبادل گاز، نشت هوادرآلوئول ( آمفیزم انترستیس، پنوموتوراکس) خونریزی ریوی یا IVH باشد. چنانچه نوزادمبتلابه RDS دچارBPD شود، مرگ نوزادبرای هفته هایا ماه ها به تعویق خواهدافتاد.
تشخیص
سیربالینی، رادیوگرافی سینه، گازهای خونی و وضعیت اسید- باز بیماربه تائیدتشخیص کمک میکند. یافتههای رادیوگرافی سینه اختصاصی است، اماپاتوگنومونیک نبوده و شامل این موارداست :الگوی رتیکولرگرانولارظریف ریه وبرونکوگرام هوا، که اغلب درابتدادرناحیه لوب تحتانی چپ به علت تاثیرسایه قلب، بارزتراست (شکل 1.5). یافتههای رادیوگرافی اولیه گاهی نرمال بوده والگوی تیپیک آن معمولا طی 12- 6 ساعت بروزمیکند. بسته به مرحله تنفس (کلیشه دم درمقایسه بابازدم) واستفاده ازCPAP یا PEEP(فشارمثبت انتهای بازدمی) یافتههای رادیوگرافی بسیارمتنوع است. این تنوع اغلب باعث میشودکه بین یافتههای رادیوگرافیک و سیربالینی بیماری ارتباط خوبی برقرارنگردد. یافتههای آزمایشگاهی بطورمشخص باهیپوکسمی وسپس هیپوکسمی پیشرونده، هایپرکاپنه و درجات متغییری ازاسیدوزمتابولیک تظاهرمی کند.
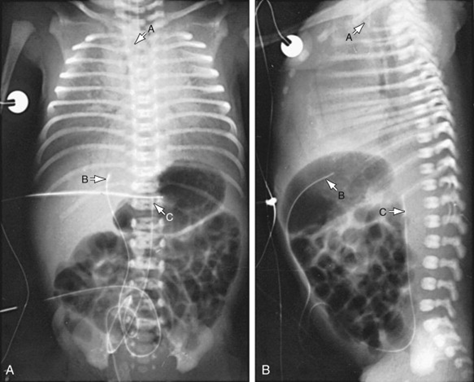
شکل 1.5: نوزادمبتلابه سندروم دیسترس تنفسی. به ریه گرانولار، برونکوگرام هوا و مری انباشته ازهواتوجه کنید. کلیشههای قدامی خلفی ( A) ولترال (B) برای افتراق کاتتروریدی ازشریانی ناف و تعیین سطح مناسب کاتتریزاسیون، موردنیازاست. نمای لترال بوضوح نشان میدهدکه کاتترواردوریدنافی شده ودرون سیستم پورتال کبدی واقع است. A: لوله اندوتراکئال. B: کاتتروریدنافی درمحل تلاقی وریدنافی، داکتوس ونوزوس و وریدپورت. C: کاتترشریان نافی که واردآئورت تاT12 شده است.
درتشخیص افتراقی باید سپسیس زودرس رامدنظرداشت. درپنومونی بدوتولد، گرافی ریه ممکن است نظیرRDS باشد. عواملی که مطرح کننده سپسیس زودرس است عبارتنداز:کلونیزاسیون مادربااسترپتوکوک گروه B، شناسائی ارگانیسم دررنگ آمیزی گرم ترشحات معده یاتراشه یا اسمیرضخیم و یا مشاهده نوتروپنی شدید.
بیماری سیانوتیک قلبی(مثل بازگشت وریدی توتال آنومالوس پولمونر[ TAPVR]) میتواندازنظربالینی ورادیوگرافیک نظیرRDS باشد. بنابراین درنوزادانی که به درمان باسورفاکتانت پاسخ نمی دهند، جهت ردبیماری سیانوتیک قلبی وهمچنین بررسی بازماندن داکتوس آرتریوزوس وارزیابی مقاومت عروق ریوی (PVR) نیازبه اکوکاردیوگرافی رنگی است. دربیمارانی که سیربالینی آتیپیک دارندبایدبه هیپرتانسیون ریوی پایدار، سندروم ها ی آسپیراسیون (مکونیوم، مایع آمنیوتیک) پنوموتوراکس خودبخودی، پلورال افوزیون و آنومالی ها ی مادرزادی مثل ناهنجاری آدنوماتوئیدکیستیک، لنفانژکتازی ریوی، هرنی دیافراگم و آمفیزم لوبار فکرکردکه البته افتراق این موارد ازRDS به کمک رادیوگرافی میسراست. تاکی پنه گذرابواسطه سیربالینی کوتاه وخفیف وعدم نیازبه اکسیژن مکمل و یااندکی نیازبه آن، مشخص میشود. پروتئینوزآلوئولارمادرزادی ( کمبودپروتئین B سورفاکتانت مادرزادی) یک بیماری نادرفامیلیال است که بصورت RDS شدید وکشنده درنوزادان ترم ونزدیک به ترم دیده میشود. درموارد RDSآتیپیک به کمک پروفایل ریه ( نسبت لستین به اسنفگومیلین و بررسی فسفاتیدیل گلیسرول)حاصله ازنمونه تراشه میتوان تشخیص کمبودسورفاکتانت راتائیدکرد.
پیشگیری
اجتناب ازسزارین غیرضروری یا بی موقع ، مراقبت صحیح از زایمان ها و بارداری های پرخطر و پیشبینی نارسی ریوی ( همراه با احتمال تقویت بلوغ ریه درداخل رحم) اقدامات مهم برای پیشگیری است. در زمان سزارین یا القاء زایمان، تخمین محیط سرجنین به کمک سونوگرافی و تعیین غلظت لستین درمایع آمنیوتیک به کمک نسبت لستین به اسفنگومیلین ( بویژه بررسی فسفاتیدیل گلیسرول درمادران دیابتیک) میتوان از زایمان نوزادپرهترم جلوگیری کرد. مونیتورینگ آنته ناتال واینتراپارتوم جنین نیزمی توانداز خطر آسفیکسی جنین بکاهد. آسفیکسی سبب افزایش شیوع وشدت RDS میشود. استروئیدآنته ناتال باعث کاهش این مواردمی شود :1) نیازبه حمایت تهویهای ومدت زمان بستری درNICU و2) شیوع شدت IVH، آنتروکولیت نکروزان، سپسیس زودرس و تاخیرتکامل. رشد پست – ناتال مختل نمی شود. استروئیدآنته ناتال، خطر مرگ مادری، کوریوآمنیونیت، یا سپسیس نفاسی رازیادنمیکند. تجویزاستروئیدبه تمامی مادرانی که زایمان زودرس(هفته 34- 24) داشته واحتمالا طی 1هفته زایمان خواهندکرد، توصیه میشود. تجویزهفتهای ومکرربتامتازون تاهفته 32 میتواند مورتالیتی ومدت زمان تهویه مکانیکی رابکاهد. گلوکوکورتیکوئیدآنته ناتال عمل سینرژستیک با تجویزسورفاکتانت اگزوژن پس ازتولد دارد، بنابراین صرف نظرازموثربودن سورفاکتانت، تجویزاین داروهاتوصیه میشود. تجویزآنته ناتال بتامتازون ودگزامتازون صورت گرفته است. دگزامتازون درمقایسه بابتامتازون ازشیوع IVH میکاهد و لی برای مشخص کردن داروی ارجح ازمیان این دو نیازبه تحقیقات بیشتری است. تجویزنخستین دوزسورفاکتانت به تراشه نوزادان پره ماچور سمپتوماتیک، بلافاصله بعدازتولد(پروفیلاکتیک) یا طی اولین ساعات زندگی( درمان زودرس ) سبب کاهش نشت هواو مورتالیتی ناشی از RDS شده، اماشیوع BPD راکم نمیکند.
درمان
نقص اصلی که در RDS نیازبه درمان دارد، تبادل ناکافی اکسیژن ودی اکسیدکربن درون ریه است. سایرمشکلات (اسیدوزمتابولیک ونارسائی گردش خون) ثانویه هستند. مراقبت حمایتی به موقع ازنوزادان پره ماچور، به خصوص درمان اسیدوز، هیپوکسی، هیپوتانسیون وهیپوترمی میتواندازشدت بیماری بکاهد. درمان شامل مونیتورینگ دقیق ضربان قلب وتنفس، اشباع اکسیژن، Pao2, Paco2, Ph، بیکربنات، الکترولیت ها، گلوکزخون، هماتوکریت، فشارخون و دمای بدن است .دراغلب مواقع نیازبه کاتتریزاسیون شریانی است. از آنجائی که اکثرموارد RDS، خودمحدودشونده است بنابراین هدف درمان، به حداقل رسانیدن متغییرهای غیرنرمال فیزیولوژیک ومشکلات یاتروژنیک بیماراست. بستری در NICUضروری است.
اصول کلی درمان حمایتی ازنوزادان پره ماچور شامل مراقبت از تکامل نوزاد و برنامهای برای “زمان تماس” میباشد[تماس بانوزادپره ماچوربایددرحداقل خودباشد، زیرامنجربه استرس وافزایش آسیب پذیری میشود، لذاتوصیه شده که تماس بانوزادطبق برنامه مشخص وبه منظوراقدامات درمانی درحداقل ممکن باشد. مترجم]. جهت جلوگیری ازهیپوترمی وکاهش مصرف اکسیژن، نوزاد باید درون وارمر تابشی یا انکوباتور قرارگرفته ودمای مرکزی بین 36.5 و37°C حفظ شود. استفاده ازانکوباتور برای نوزادان VLBW مناسب تراست، زیرااتلاف آب نامحسوس دراثروارمر تابشی برای این نوزادان شدیدتراست. تجویزاولیه کالری و مایعات، باید بطوروریدی باشد. برای 24 ساعت اول، گلوکز10% وآب باسرعت 65–75 mL/kg/24 hr ازورید محیطی توصیه میشود. الکترولیت رامی توان درروز2 تولدبرای نوزادان رسیده ترودرروز3تا7 برای نوزادان نارس تر، اضافه کرد. حجم مایع طی هفته اول، به تدریج اضافه میشود. تجویزفراوان مایع (> 140 mL/kg/day) دربروز PDA و BPD دخالت دارد. اکسیژن مرطوب وگرم راباید ابتداباغلظتی دادکه بتوان فشاراکسیژن شریانی رابین 40 و 70 mm Hg ( 1-85% اشباع) حفظ نمود دراین صورت اکسیژناسیون نرمال بافت تامین شده ودرضمن از خطر توکسیستی اکسیژن نیزکم میشود.
اگربااکسیژن تنفسی 70-40% یابیشترنتوان اشباع اکسیژن را> 85% حفظ کرد، استفاده از CPAP بافشار5-10 cm H2O توسط کانولای بینی توصیه میشود، که معمولا سبب افزایش سریع دراکسیژناسیون خواهدشد. استفاده از CPAP میتواندمانع ازکولاپس آلوئول ها ی فقیرازسورفاکتانت وبهبودFRC وتعادل تهویه – پرفوزیون شود. استفاده به موقع از CPAP ( ازهمان اتاق زایمان) جهت تثبیت نوزادان VLBW که درمعرض خطرهستند، میتواندنیازبه تهویه مکانیکی راکم کند. روش دیگر، اقدام به انتوباسیون نوزادان VLBW، تجویزسورفاکتانت و سپس اکستوبه کردن واقدام به CPAP میباشد. میزان نیازبه CPAP طی 72 ساعت کاهش یافته وپس ازآن میتوان اکثرنوزادان راجداکرد. درصورت استفاده ازCPAP برای نوزادمبتلا به RDS وعدم رسیدن به اشباع اکسیژن > 85% به هنگام استنشاق ازاکسیژن 100-40%، نیازبه تهویه مکانیکی وسورفاکتانت است.
نوزادمبتلابه نارسائی تنفسی یا آپنه پایدارنیازمندتهویه مکانیکی است. معیارهای نارسائی تنفسی عبارتنداز:1) pH شریانی کمتراز7.2، 2) Pco2 شریانی 60 mmHg یابیشتر و 3) اشباع اکسیژن <85% باغلظت اکسیژن100-40% و CPAP بافشار 5–10 cm H2O. نوزادمبتلابه آپنه پایدارنیزنیازمندتهویه مکانیکی است. تهویه بافشارمثبت متناوب که به روش سیکل – زمانی، محدودبه فشاروباجریان پیوسته صورت گیرد، روش شایع تهویه مکانیکی متعارف نوزادان است. سایر روش های تهویه متعارف عبارت است از:تهویه اجباری متناوب سنکرونیزه(فشاروسرعت دستگاه، باتنفس خودبیمارسنکرونیزه میشود) تهویه باحمایت فشاری(دستگاه بانفس بیمارتحریک شده وفشارازقبل تنظیم شدهای راآزادمی کند) و تهویه حجمی(دراین روش، حجم جاری خاصی تنظیم شده وفشارتحویلی متغییراست) و ترکیبی از این موارد . تهویه مکانیکی برای نوزادمبتلابه RDS همواره باید شامل PEEP باشد. سرعت ها ی تهویه بالا(60 دردقیقه) سبب نشت کمترهوامی شود. درصورت استفاده ازسرعت تهویهای بالا، لازم است تابه منظوراجتناب از PEEP نامناسب، زمان بازدم کافی باشد. هدف ازتهویه مکانیکی، بهبوداکسیژناسیون وحذف دی اکسید کربن بدون ایجادباروترومای ریوی یا مسمومیت بااکسیژن است. مقدارگازهای خونی مطلوب بادرنظرگرفتن خطر هیپوکسی واسیدوزدرمقایسه باعوارض تهویه مکانیکی، درمراکزمختلف فرق میکندولی شامل Pao2 of 40–70 mm Hg, Paco2 of 45–65 mm Hg و pH of 7. 20–7. 35 میباشد. درطی تهویه مکانیکی، بهبوداکسیژناسیون با افزایش Fio2، یا افزایش متوسط فشارمجرای هوا (اینموردرامی توان باافزایش فشارپیک دمی، جریان گاز، نسبت دم به بازدم، یا PEEP بدست آورد) صورت میگیرد. تغییرفشارمعمولابیشترموثرواقع میشود. معهذا PEEPبالا، می تواندباجلوگیری ازبازگشت وریدی سبب کاهش برونده قلبی وبنابراین کاهش اکسیژناسیون بافتی علی رغم بهبودPao2 شود. مقدارمطمئن وموثر PEEP معمولا 6-4 سانتیمترآب میباشد. حذف دی اکسید کرین، باافزایش فشارپیک دمی(حجم جاری) یا سرعت ونتیلاتورصورت میگیرد. روش کاستن ازآسیب ریه ناشی ازتهویه مکانیکی، استفاده از CPAP به جای انتوباسیون تراشه است.
کاهش استفاده ازتهویه مکانیکی بواسطه اقدام به CPAP، میتواندبه هواگیری ریه کمک کرده وهمچنین مانع ازترومای حجمی (volutrauma) ناشی ازاتساع مفرط ویاآتلکتازی ریه شود. البته بررسیهای کنترل شده درمورداستفاده زودرس از CPAP، مزیتی برای آن نشان نداده است. جالب آنکه تهویه اجباری متناوب بینی (درمقایسه با CPAP بینی) نارسائی اکستوباسیون رادرمعدودی بررسیها نشان داده است. ازاین روش میتوان جهت اجتناب ازانتوباسیون، به عنوان روش جانشین استفاده کرد.
روشی که بسیارموردبررسی قرارگرفته، تهویه مکانیکی متعارف به کمک سرعت بالاو احتمالا حجم جاری کم است به گونه ای که بتوان سطح Paco2 رادرطیف قابل قبولی حفظ کرد. با متاآنالیزچندین بررسی کنترل شده راندوم، مقایسهای بین روش های باسرعت بالا(بیش از60 دردقیقه) وپائین (معمولا 40-30 دردقیقه) ویا به ترتیب باحجم جاری پائین درقیاس باحجم بالا صورت گرفت که نشان داده روش سرعت تهویه بالا باعث کاهش نشت هوا و افزایش میزان بقاء میشود. درصورت نیازبه تهویه مکانیکی توصیه میشودازحجم جاری کم وهیپرکاپنی مجاز، استفاده شود. درروش هیپرکاپنی مجاز،تهویه مکانیکی بگونهای انجام میشودکه آسیب ریه ناشی ازتهویه، با برقراری Paco2 نسبتا بالا به جای نرمال نگه داشتن آن به حداقل برسد. بررسی متعددنوزادان با وزن ≤1,000 g نشان داده که هیپرکاپنه مجاز(Paco2 >50 mm Hg) طی 10 روزاول درمان باعث میشودتاازمیزان BPD یامرگ درهفته 36 بکاهد. روش هیپرکاپنه مجازسبب میشودتاازشدت BPD کاسته شود، زیراشواهدنشان داده که نیازبه حمایت تهویهای درهفته 36 از16% به 1% کاهش مییابد. بررسی بزرگتر درچندمرکزنشان دادکه استفاده از CPAPمیتواندروش موثروارجح درمان نوزادان پرهترم مبتلا RDS، درمقایسه باانتوباسیون وتجویزسورفاکتانت باشد. تهویه حجمی به پزشک اجازه میدهدتا حجم جاری رابگونهای تنظیم نمایدتامانع ازترومای حجمی گردد. البته اطلاعات فعلی درموردتهویه حجمی ناچیزاست و لی این روش ممکن است ازمیزان پنوموتوراکس و BPD کم کند. هیپراکسی نیزممکن است درآسیب ریه نوزادان پرهترم دخالت داشته باشد. بنابراین هیپوکسمی مجاز، روش دیگری برای کاهش BPD میباشد. دربررسیهای مختلفی که بااشباع اکسیژن متفاوتی جهت درمان رتینوپاتی نارسی یا BPD صورت گرفته، دیده شده است که گروه تحت درمان بااشباع کمتر(به ترتیب 94-89% یا 94-91%) نیازکمتری به اکسیژن وشانس کمتری برای BPD یا عود BPD دارند. حتی درجات کمتراشباع اکسیژن (89-85%) به شدت ازرتینوپاتی پره ماچوریتی کاسته ومیزان BPD راکم میکندولی چندین بررسی بزرگ کنترل راندوم نشان داد که میزان مورتالیتی افزایش می یابد. بنابراین هنوزدرجه اشباع مطلوب نامشخص مانده است ولی به نظر می رسد که اندکی محدودیت درمصرف اکسیژن، مفیدباشد.
بسیاری نوزادان تحت ونتیلاتور، نیازبه سداسیون یاتسکین درد(به ترتیب)بابنزودیازپینها ویا مخدر(مورفین، فنتانیل) دارند. میدازولام، برای نوزادان تائیدشده واثرات سداتیومشخصی دارد. عوارض همودینامیک ومیوکلونوس بامصرف آن دیده شده است. برای کاهش این خطرات، توصیه به انفوزیون پیوسته یاتجویزدوزهای منفرددست کم طی 10 دقیقه شده است. دادههای موجودبرای بررسی کارائی وایمنی لورازپام کافی نیست. دیازپام به علت نیمه عمرطولانی، متابولیت ها ی طولانی اثر و نگرانی درموردجزء بنزیل الکل دردیازپام تزریقی، توصیه نمی شود. انفوزیون مداوم مورفین به نوزادان VLBW که تحت ونتیلاتورهستند، باعث کاهش مورتالیتی ، IVH شدید، یا لکومالاسی پری ونتریکولارنمی شود. نیازبه دوزهای مکررمورفین، باپیامدضعیف همراه بوده است.
تهویه بافرکانس بالا( HFV) به تهویه مطلوب آلوئولی ازطریق حجمهای جاری کوچک تر و سرعت ها ی بالاتر( 300-1,200 breaths/min or 5-20 Hz) کمک میکند. HFV سبب حذف بهتردی اکسید کربن وبهبوداکسیژناسیون دربیمارانی میشود که پاسخی به تهویه متعارف نداده ودچار RDSشدید، آمفیزیم انترستیس، پنوموتوراکس راجعه، یا پنومونی آسپیراسیون مکونیوم هستند. تهویه اوسیلاتوری فرکانس بالا(HFOV) و تهویه جت فرکانس بالا(HFJV) از شایع ترین روش های HFV هستند. درروش HFOV ازمیزان BPD کاسته شده ولی نشت هواافزایش یافته وممکن است خطر IVH و PVLبیشترشود. در روش هائی از HFOVکه به کمک تجویزسورفاکتانت، کارائی ریه بهبودی می یابد می توان تبادل گازدرون ریه راافزایش داد. روش HFJV سبب برطرف شدن نشت هوامی شود. البته استفاده از هریک از روش های فوق چنانچه به عنوان روش اولیه برای نوزادان مبتلابه RDS مدنظرباشد، درمقایسه با تهویه متعارف عمدتا مزیتی ندارد. نقص اولیه در RDS، کمبودسورفاکتانت میباشد. اثرات فوری تجویزسورفاکتانت شامل این موارداست :بهبودگرادیان اکسیژن آلوئولی – شریانی، کاهش حمایت تهویهای، افزایش کمپلیانس ریوی و بهبودنمای رادیوگرافی سینه. شروع به درمان حتی الامکان طی چندساعت اول تولدتوصیه میشود. دوزهای متعددسورفاکتانت، کلا2تا4 دوز، هر12-6 ساعت ازطریق لوله تراشه بسته به نوع محصول داده میشود. سورفاکتانت اگزوژن بایدتوسط پزشکی تجویزگرددکه دراحیاء نوزادان ومراقبت تنفسی باتجربه بوده وتوانائی مراقبت ازنوزادپس از1 ساعت تثبیت بیمارراداشته باشد. سایراعضاء گروه حمایتی آماده درمحل شامل پرستار ومتخصص درمان تنفسی مجرب درتهویه مصنوعی نوزادپره ماچوراست. تجهیزات مناسب مونیتورینگ (رادیولوژی، تجهیزات گازخون، پالس اکسیمتری) نیزبایدفراهم باشد. عوارض تجویزسورفاکتانت شامل هیپوکسی گذرا، هیپرکاپنه، برادیکاردی وهیپوتانسیون، انسدادلوله تراشه و خونریزی ریوی است . چندین محصول سورفاکتانت، شامل انواع صناعی و فراوردههای طبیعی حیوانی، موجوداست. اگزوسورف (Exosurf) یک نوع صناعی است. سورفاکتانت طبیعی شامل سوروانتا (Survanta، منشاء گاوی) اینفاسورف ( Infasurf، گوساله) وکوروسورف (Curosurf، خوکی) میباشد. درمان باسورفاکتانت، از پیشرفت های مهم درمراقبتهای نوزادان پرهترم است. تجویزپروفیلاکتیک ورهائی بخش (Rescue) سورفاکتانت صناعی وطبیعی سبب کاهش عوارض ازجمله مورتالیتی شده است. به خصوص مورتالیتی نوزادان درمصرف پروفیلاکتیک (درمقایسه با رهائی بخش) هردونوع سورفاکتانت کاهش یافته است. تجویزپروفیلاکتیک هردونوع، منجربه کاهش خطر پنوموتوراکس و آمفیزم انترستیس ریه میشود. عدم کاهش درمیزان BPD به دنبال تجویزسورفاکتانت احتمالاتاحدی ناشی ازبقاء نوزادان مبتلا به RDS میباشدکه بدون تجویزسورفاکتانت، حتمافوت میشده اند.
سیاست تجویزپروفیلاکتیک سورفاکتانت درنوزادان پرهترم رسیده تر، میتواندسبب مصرف غیرضروری سورفاکتانت شودواحتمالاتجویززودرس به جای تجویزپروفیلاکتیک میتواندبقدرکافی موثرباشد. زمان تجویزسورفاکتانت رهائی بخش( Rescue) درچندین بررسی بسیارمتفاوت بوده است. تجویزسورفاکتانت رهائی بخش زودرس (زیر2ساعت) به جای رهائی بخش تاخیری، منجربه کاهش خطر مورتالیتی نوزادی شده است. تجویزرهائی بخش زودرس ازمیزان پنوموتوراکس (از14% به 12%) و آمفیزم انترستیس ریه (از15% به 10%) کاسته است. روش جانشین برای تجویزرهائی بخش زودرس دربسیاری ازنوزادان، تجویزسورفاکتانت قبل ازنیازبه تهویه است. انتوباسیون موقت تراشه جهت تجویزسورفاکتانت درنوزادانی که نیازبه CPAP دارند، ازنیازبعدی به تهویه مکانیکی کاسته ومی تواند مورتالیتی ویاBPD راکم کند.
مقایسه کامل سورفاکتانت های صناعی وطبیعی، ارجحیت نوع طبیعی رانشان داده است. استفاده ازسورفاکتانت طبیعی (درقیاس با صناعی) سبب پنوموتوراکس (7% درقیاس با7%) و مورتالیتی (18% درقیاس با16%) کمتری نسبت به نوع صناعی شده است. نوع طبیعی بواسطه دارابودن پروتئین وابسته به سورفاکتانت، سرعت عمل بیشتر و خطر کمترپنوموتوراکس ونیزبهبودبقاء نوزاد، نوع برترمی باشد. سورفاکسین (Surfaxin) قبلابنام سورفاکتانت KL4 ، یک سورفاکتانت نوین صناعی است که حاوی فسفولیپید ویک پپتید مصنوعی (sinapultide) که عمل آن شباهت به SP-B انسانی دارد، می باشد. استفاده ازسورفاکسین جهت پیشگیری ودرمان RDS، کارائی نظیرسورفاکتانت (Survanta و Curosurf) دارد. در روش های اولیه برای تجویزسورفاکتانت ازتک دوزآن استفاده میشد. ولی روش تجویزچنددوزسورفاکتانت در صورتی که اندیکاسیون داشته باشد، درمقایسه با تک دوزآن، باکاهش خطر پنوموتوراکس (18% درمقایسه با9%) وکاهش مورتالیتی همراه است. بامرورکلیه شواهدموجود، توصیه به تجویزپروفیلاکتیک یا زودرس سورفاکتانت طبیعی درنوزادان نیازمندبه CPAP، شده است. درصورت نیازبرای مناسب کردن مزایای درمان میتوان بیش ازیک دوزسورفاکتانت تجویزکرد.
نوزادان پره ماچوری که نیازمندتهویه مکانیکی پس ازهفته اول زندگی هستند، دچارحملات گذرای اختلال درعملکردسورفاکتانت توام با کمبود SP-B و SP-Cخواهندشدکه بطورموقت باحملات عفونت واختلال تنفسی همراه میباشد.
اکسیدنیتریک استنشاقی( iNO) درنوزادان ترم ونزدیک به ترمی که مبتلابه نارسائی هیپوکسیک تنفسی یاهیپرتانسیون پایدارپولمونر هستند، نیازبه ECMO (اکسیژناسیون غشائی اکستراکورپورال) راکم میکند. پاسخ به iNO نظیرپاسخ به HFOV درنوزادان ترم یانزدیک به ترم مبتلابه نارسائی تنفسی هیپوکسیک میباشد. پاسخ مثبت به درمان ترکیبی، بیانگرآن است که بازیافت آلوئول ها درروش HFOV به گاز iNO اجازه میدهدتابه عروق مقاوم ریه دسترسی یابد. تنهادریک مطالعه دیده اندکه میزان مرگ یا BPD درنوزادان <1,000 g تحت درمان با گاز iNO، کاهش یافته است.
راهکارجداسازی (Weaning strategies) نوزادان ازونتیلاتوربسیارمتنوع بوده وبستگی به مکانیک ریه ونیزمدهای ونتیلاتور(حمایت فشاری) دارد. درموردبسیاری ازنوزادان باجداکردن ازونتیلاتور، باید به منظوراجتناب ازآتلکتازی و هیپوکسی از نازال CPAP استفاده شود. تهویه سینکرونیزه متناوب نازال، سبب کاهش نیازبه انتوباسیون مجدددرنوزادان پره ماچورمی شود. استفاده ازاکسیژن نازال باجریان بالا(2-1 لیتردردقیقه) یا جریان بالای مرطوب وگرم(8-2لیتردردقیقه) جهت حمایت از نوزادان ترم ونزدیک به ترم به دنبال اکستوباسیون و نیزجداسازی نوزادپره ماچور ازنازال CPAP، توصیه میشود. تجویزاولیه متیل گزانتین ها، می تواند موفقیت اکستوباسیون رازیادکند.
درمان ها ی داروئی
برای درمان RDS و جلوگیری ازعوارض آن، داروهائی مختلفی دراختیاراست. برخی درمان هادراینجابررسی میشوند.
تجویزویتامین A که عمدتا به نوزادان < 1,000 g داده میشودسبب کاهش مرگ ویا BPD درهفته 36 ( از66% به 60%) وهمچنین کاهش سپسیس بیمارستانی ورتینوپاتی نارسی میشود.
کورتیکواستروئیدهای سیستمیک برای درمان RDS، درمان انتخابی برخی نوزادان نیازمندحمایت تنفسی مداوم و درمان نوزادانی که دچارBPD شدهاند، استفاده شده است. باتجویزتقریبا زودرس (14-7 روز) کورتیکواستروئید، ازمیزان مورتالیتی ویا BPD درهفته 36 کاسته (از72% به 45%) میشود. تجویززودرس (کمتراز96ساعت)وتاخیری(بیش از3-2هفته) استروئیدسیستمیک نیزموردارزیابی متاآنالیزقرارگرفته، که نتایج ازنظرکیفی یکسان بوده است. البته عوارض کوتاه مدت، شامل هیپرگلیسمی، هیپرتانسیون، خونریزی گوارشی، پرفوراسیون گوارشی، کاردیومیوپاتی انسدادی هیپرتروفیک ، وزن گیری ضعیف، رشد ضعیف سر و افزایش ابتلاء به PVL دیده شده است. وانگهی دادههای موجودبیانگرافزایش شیوع تاخیرتکامل وفلج مغزی درنوزادانی است که بطورراندوم تحت درمان بااستروئیدسیستمیک بودهاند، که این خودنگرانی هائی راجع به نتایج درازمدت این نوع درمان ایجادکرده است. بنابراین گروه مشترک آکادمی طب اطفال آمریکا و انجمن کودکان کانادا استفاده رایج ازاستروئیدسیستمیک برای پیشگیری یادرمان BPD راتوصیه نمیکند. تجویزاستروئیداستنشاقی به نوزادان پرهترم تحت تهویه طی 2 هفته اول تولد، ازنیازبه استروئیدسیستمیک (از45% به 35%) وهمچنین ازمیزان مرگ ویا BPD درهفته 36 بدون هرگونه افزایشی درعوارض آن میکاهد. پس ازمشاهده کارائی گاز NO استنشاقی در نوزادان ترم ونزدیک به ترم مبتلابه نارسائی تنفسی هیپوکسمیک، استفاده ازآن درنوزادان پرهترم موردارزیابی قرارگرفته است. صرف نظرازنتایج مطلوبی که ازتحقیقات وسیع کنترل راندوم به دست آمده ، معهذا بررسی درنوزادان پرهترم بانتایج متنوعی برBPD، مورتالیتی و سایرعواقب مهم همراه بوده است. جدیدترین داده هاهرگزمهر تائید براستفاده رایج ازگاز NO در نوزادان پرهترم مبتلابه نارسائی تنفسی هیپوکسمیک نزده است. باتجویزداروهای مختلف، سعی برجلوگیری ازنارسائی اکستوباسیون شده است. ظاهرامتیل گزانتین هاتاثیری عمده برکاهش نارسائی اکستوباسیون (از51% به 25%) دارد. همچنین استفاده ازاستروئیدسیستمیک قبل ازاکستوباسیون، نیازبه انتوباسیون مجددرا(از10% به 1%) کم میکند. اماتجویزاپی نفرین راسمیک پس ازاکستوباسیون، سبب بهبودی عملکردریه یا میزان نارسائی اکستوباسیون نمی شود.
اسیوزمتابولیک در RDS ناشی ازآسفیکسی وهیپوتانسیون پری ناتال بوده ومعمولازمانی دیده میشود که نوزاد نیازبه احیاء داشته باشد. درمان باتجویز بیکربنات سدیم 1–2 mEq/kg، طی 20- 15 دقیقه ازمسیروریدنافی یامحیطی همراه باکنترل وضعیت اسید- بازخون طی 30 دقیقه. یاتجویز طی چندساعت میباشد. بیکربنات سدیم رااغلب درموارداورژانسی میتوان ازطریق وریدنافی تجویزکرد. عوارض این درمان شامل این موارداست :آسیب پوستی ناشی ازنشت، افزایش اسمولاریته سرم، هایپرناترمی، هیپوکلسمی، هیپوکالمی و آسیب کبد (در صورتی که تجویزمحلول غلیظ ازراه کاتترنافی مستقردرون کبدباشد).
مونیتورینگ فشارخون آئورت به کمک کاتترشریان محیطی یا نافی یا به روش اوسیلومتریک درنوزادان باوضعیت شوک، که ممکن است طی اولین ساعات در نوزادان نارسی که آسفیکسی کشیده ویا مبتلابه RDS باشد(شکل 94.2) ضروری است. موقعیت کاتترنافی رادیواوپاک رابایدپس ازقراردادن آن به کمک رادیوگرافی تائیدکرد(شکل 1.5). نوک کاتترشریان نافی باید درست بالای انشعاب آئورت (L3-L5) یا بالای محورسلیاک (T6-T10) قرارداشته باشد. مسیرهای مناسب برای کاتتر محیطی عبارتنداز شریان های رادیال یا پوستریورتیبیا. قراردادن کاتترونظارت برآن باید به عهده فردماهرومجرب باشد. بلافاصله پس ازآنکه نیازنوزادبه کاتتربرطرف گردد، معمولا هنگامی که وضعیت نوزادتثبیت شده و Fio2 < 40% باشد، باید اقدام به درآوردن آن کرد. هیپوتانسیون وجریان خون پائین دروریداجوف فوقانی (SVC) بامیزان بالائی از موربیدیتی CNS و مورتالیتی همراه بوده وبایدباتجویزدقیق حجم (کریستالوئید) واستفاده سریع ازوازوپرسوردرمان گردد. دوپامین درافزایش فشارخون موثرترازدوبوتامین است. هیپوتانسیون ممکن است مقاوم به وازوپرسوربوده ولی به گلوکوکورتیکوئید، به خصوص درنوزادان زیر1000گرم، پاسخ دهد. هیپوتانسیون ممکن است به علت نارسائی گذرای آدرنال درنوزادپره ماچورناخوش باشد. این موردرابایدباهیدروکورتیزون وریدی (Solu-Cortef) بادوز 1-2 mg/kg/dose q6-12 hr درمان کرد.
موینتورینگ پریودیک Pao2, Paco2 و pHبخش مهمی ازمراقبت بوده ودر مواردی که تهویه مصنوعی شروع شده، ضروری است. اکسیژناسیون رامی توان به کمک الکترودهای جلدی یا پالس اکسیمتری(اشباء اکسیژن) کنترل نمود. نمونه خون مویرگی برای بررسی فشاراکسیژن مناسب نیست، امامی تواندبرای کنترل Paco2 و pH مفید باشد.
بخاطرمشکل بودن افتراق عفونت استرپتوکوک گروه B یاسایرعفونتهای باکتریال از RDS، توصیه به تجویزآنتی بیوتیک تجربی تازمان آماده شدن نتیجه کشت خون میشود. پنی سیلین یا آمپی سیلین همراه با آمینوگلیکوزید توصیه میشود، هرچندکه انتخاب آنتی بیوتیک بایدبراساس حساسیت باکتریال دربیمارستان محل بستری نوزادباشد.
پیش آگهی
آمادگی به موقع برای مراقبتهای ویژه ومراقبت ازنوزادان پرخطرمی توانداز موربیدیتی و مورتالیتی ناشی ازRDS وسایرناخوشیهای حادنوزادی به شدت بکاهد. استروئیدآنته ناتال، سورفاکتانت پست ناتال و مدهای بهترونتیلاتورباعث کاهش مورتالیتی ناشی از RDS(حدود10%) شده است. باکاهش سن بارداری، مورتالیتی نیزبیشترمی شود. بهبودنتایج بستگی به وجودپرسنل مجرب وماهر، بستری در بیمارستان های مجهزواختصاصی، تجهیزات مناسب و فقدان عوارض مثل آسفیکسی شدید، خونریزی اینتراکرانیال، یا ناهنجاری های مادرزادی غیرقابل درمان دارد. تجویزسورفاکتانت باعث کاهش حدود40% از مورتالیتی RDS شده است و لی شیوع BPD چندان تغییرنکرده است.
هرچندکه 90-85% نوزادان مبتلابه BPD که پس ازحمایت ونتیلاتورزنده میمانند، نرمال هستندولی نتیجه برای نوزادانی که وزن آنها > 1,500 g میباشد بهتراست. پیش آگهی طولانی مدت ازنظرعملکردنرمال ریه در اکثرنوزادانی که به دنبال RDS زنده می مانند ، عالی است. اماآنهائی که نارسائی شدیدتنفسی داشته اندممکن است دچارمشکلات مهم ریوی واختلال عصبی گردند. علائم پروگنوستیک ضعیف شامل این موارداست : ونتیلاسیون طولانی، IVH، هیپرتانسیون ریوی، کورپولمونل و و ابستگی به اکسیژن بعدازیک سالگی . مورتالیتی نوزادان مبتلابه BPD از10تا25% متفاوت است ودرنوزادان باوابستگی بیش از6 ماه به ونتیلاتور به شدت افزایش مییابد. علل شایع مرگ شامل نارسائی قلبی ریوی توام باکورپولمونل و عفونت اکتسابی(ویروس سنسیسیال تنفسی) میباشد. نوزادان زنده مانده از BPD اغلب تحت درمان بااکسیژن، دیورتیک و برونکودیلاتورازبیمارستان ترخیص میشوند. عوارض غیرقلبی ریوی BPD، علاوه برعوارض درمان ( مثل نفرولیتیاز، اوستئوپنی و عدم تعادل الکترولیت) شامل نارسائی رشد، تاخیر سایکوموتور و استرس والدین است. مشکلات مجاری هوائی نظیر هیپرتروفی تونسیل و آدنوئید، فلج طناب صوتی، تنگی ساب گلوتیک و تراکومالاسی شایع بوده وممکن است سبب هیپرتانسیون پولمونرویاتشدیدآن شوند. تنگی ساب گلوتیک ممکن است نیازمندتراکئوتومی یا جداسازی قدامی کریکوئید جهت برطرف کردن انسدادفوقانی تنفسی باشد. عوارض قلبی BPD شامل هیپرتانسیون پولمونر، کورپولمونل، هیپرتانسیون سیستمیک، هیپرتروفی بطن چپ و تشکیل عروق کولاترال آئورتوپولمونل( که اگربزرگ باشدمی تواندسبب نارسائی قلبی شود) است. عملکردریه دراکثرنوزادان بازمانده ازبیماری، به علت تداوم رشدوترمیم ریه ومجاری هوائی، به تدریج بهترمی شود. بستری مجدد به علت مشکلات تنفسی در2سال اول زندگی بسیارشایع است. کاهش تدریجی دردفعات علائم بیماری (که وفورآن در2 سال اول است) درسنین 9-6 سالگی دیده میشود. تداوم علائم تنفسی وعملکردغیرنرمال ریوی درکودکان 10-7 سال دیده میشود. انسدادمجاری تنفسی وازدیادفعالیت مجاری (hyperactivity) وپرهوائی دربرخی نوجوانان وبالغین بازمانده ازبیماری دیده میشود. مطالعه با MRI ویا CT بارزولیشن بالا درکودکان وبالغینی که سابقه BPD داشتهاند، نشان دهنده ناهنجاری ها ئی است که مستقیماباشدت ناهنجاری عملکردریه آنهاارتباط دارد.