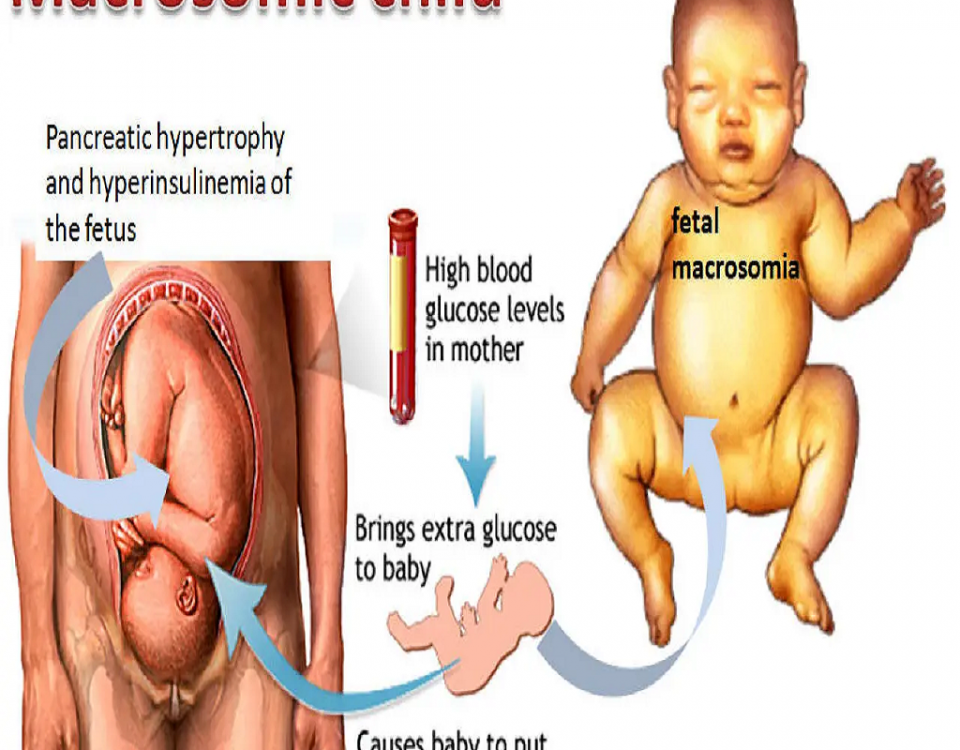
گالری ویدیوهای نوزادان و کودکان
اسفند ۱۶، ۱۴۰۲
القاء و استعاره اقيانوس براي شبادراري
اسفند ۱۷، ۱۴۰۲اکسیژن رسانی غشایی خارج بدنی
اکسیژنرسانی غشایی خارج از بدن (ECMO)، نوعی حمایت حیاتی برونبدنی است که برای افرادی که قلب و ریههایشان قادر به تأمین مقدار کافی اکسیژن،و تبادل گاز یا خون (پرفیوژن) نیستند،می تواند حمایت طولانیمدت قلبی و تنفسی را فراهم کند. فناوری ECMO عمدتاً از بای پس قلبی ریوی مشتق شده است، که پشتیبانی کوتاهمدتی را همراه با توقف گردش خون طبیعی فراهم میکند. دستگاه مورد استفاده درواقع یک اکسیژن ساز غشایی است که به عنوان ریه مصنوعی نیز شناخته می شود.
ECMO با انحراف موقت جریان خون از بدن کار می کند تا بدینگونه اکسیژناسیون مصنوعی به گلبول های قرمز خون و حذف دی اکسید کربن را امکان پذیر کند. به طور کلی، از بای پس قلبی ریوی جهت درمان مراحل پایانی نارسایی عمیق قلبی و/یا ریوی استفاده می شود، اگرچه اکنون به عنوان درمانی برای ایست قلبی نیزاستفاده می شود ،بگونه ای که در این فاصله امکان درمان علت زمینه ای را فراهم می کند. ECMO همچنین برای حمایت از بیماران مبتلا به پنومونی حاد ویروسی مرتبط با COVID-19 در مواردی که تهویه مصنوعی به تنهایی برای حفظ سطح اکسیژن خون کافی نبوده، استفاده شده است.
مصارف پزشکی
دستورالعملهایی که نحوه استفاده از ECMO را توصیف میکنند توسط سازمان حمایت از زندگی برونبدنی (ELSO) منتشر شدهاند. معیارهای شروع ECMO بسته به مؤسسه گوناگون، متفاوت است، اما عموماً شامل نارسایی حاد قلبی یا ریوی است که به طور بالقوه برگشت پذیر بوده و به مدیریت معمولی پاسخ نداده باشد. نمونه هایی از موقعیت های بالینی که ممکن است به ECMO پاسخ دهد شامل موارد زیر است:
- نارسایی تنفسی هیپوکسمیک با نسبت فشار اکسیژن شریانی به کسراکسیژن دمی (PaO2/FiO2) کمتر از 100 میلی متر جیوه علیرغم بهینه سازی تنظیمات ونتیلاتور،شامل کسر اکسیژن دمی (FiO2)، فشار انتهای بازدمی مثبت (PEEP)، و نسبت دمی به بازدمی (I:E).
- نارسایی تنفسی هیپرکاپنیک با pH شریانی <7.20
- شوک کاردیوژنیک مقاوم
- طوفان تیروئید
- ایست قلبی
- عدم جداشدن از بای پس قلبی ریوی پس از جراحی قلب
- به عنوان پلی برای پیوند قلب یا قرار دادن دستگاه کمکی بطنی
- به عنوان پلی برای پیوند ریه
- شوک سپتیک یک کاربرد بحث برانگیزبرای این روش است، اما به طور فزاینده ای مورد توجه قرار گرفته است.
- هیپوترمی، با دمای مرکزی بین 28 تا 24 درجه سانتی گراد و ناپایداری قلبی، یا با دمای مرکزی زیر 24 درجه سانتی گراد.
در افراد مبتلا به ایست قلبی یا شوک قلبی، اعتقاد بر این است که بقا و نتایج خوب را بهبود می بخشد. با این حال، یک کارآزمایی بالینی اخیر نشان داده که در بیماران مبتلا به شوک قلبی به دنبال انفارکتوس حاد میوکارد، ECLS بقا را بهبود نمی بخشد (که از طریق بررسی مرگ و میر 30 روزه اندازه گیری می شود). در مقابل، منجر به افزایش عوارض (به عنوان مثال، خونریزی شدید، ایسکمی اندام تحتانی) شده است. این یافته توسط یک متاآنالیز اخیر که از دادههای چهار کارآزمایی بالینی قبلی استفاده کرده بود، تأیید میشود،این یافته نیاز به ارزیابی مجدد دستورالعملهای فعلی برای شروع درمان ECLS را نشان می دهد.
کاربرد در بیماران COVID-19
از اوایل فوریه 2020، پزشکان در چین به طور فزاینده ای از ECMO به عنوان یک حمایت کمکی برای بیمارانی که با پنومونی حاد ویروسی مرتبط با عفونت SARS-CoV-2 مراجعه نمودند، استفاده کردند، در حالی که تنها با استفاده از ونتیلاتور، سطح اکسیژن خون در این بیماران بسیار پائین باقی مانده و لذا سبب آسیب رسانیدن به بیمار می گردد. گزارشهای اولیه نشان میدهد که استفاده از ایکمو، به بازیابی اشباع اکسیژن خون بیماران و کاهش مرگ و میر در میان تقریباً 3 درصد موارد شدیدی که نیازمند دستگاه شدند، کمک نموده است.برای بیماران بدحال، میزان مرگ و میر از حدود 59 تا 71 درصد (با روش های متعارف درمان) به تقریباً 46 درصد با اکسیژن رسانی غشایی خارج از بدن کاهش می یابد. یک داستان روی جلد لس آنجلس تایمز در مارس 2021، اثربخشی ECMO را در یک بیمار مبتلا به کووید بسیار چالش برانگیز نشان داد. در فوریه 2021، سه زن باردار اسرائیلی که مبتلا به نوع “بسیار جدی” کووید-19 بودند تحت درمان ECMO قرار گرفتند ،که به نظر می رسید این گزینه درمانی بتواند به روشی رایج تبدیل شود.
عواقب
مطالعات اولیه مزایای استفاده از ECMO را برای افراد مبتلا به نارسایی حاد تنفسی به ویژه در زمینه سندرم زجر تنفسی حاد نشان داده بود.یک رجیستری که توسط ELSO از نزدیک به 51000 نفر که ECMO دریافت کردهاند، نتایجی را با 75 درصد بقا برای نارسایی تنفسی نوزاد، 56 درصد بقا برای نارسایی تنفسی کودکان و 55 درصد بقا برای نارسایی تنفسی بزرگسالان گزارش کرده است. سایر کارآزماییهای بالینی مشاهدهای و کنترلنشده ، میزان بقا را از 50 تا 70 درصد گزارش کردهاند. این نرخهای بقای گزارششده بهتر از نرخهای بقای تاریخی هستند. هرچند که ECMO برای طیف وسیعی از بیماری ها با نرخ های مرگ و میر متفاوت استفاده می شود،ولی تشخیص زودهنگام بیماری، قدم اصلی برای جلوگیری از پیشرفت وخامت و افزایش نتایج بقا می باشد.
در بریتانیا، تجهیزات ECMO وریدی-وریدی در مراکز تعیینشده ECMO متمرکز شده است تا بدینگونه بتوانند مراقبت را بهبود بخشیده و نتایج بهتری بدست آید.
موارد منع مصرف
اکثر موارد منع مصرف نسبی هستند و خطرات این روش را در مقابل مزایای بالقوه متعادل می کنند. موارد منع مصرف نسبی عبارتند از:
- چنانچه در صورت بهبودی فرد، شرایط زندگی نرمال برای بیمار فراهم نگردد.
- شرایط قبلی که بر کیفیت زندگی موثر باشند (وضعیت CNS، بدخیمی در مرحله نهایی، خطر خونریزی سیستمیک با ضد انعقاد)
- سن و اندازه
- بیهودگی: کسانی که بیش از حد بیمار هستند، برای مدت طولانی تحت درمان متعارف بوده اند یا بیماری کشنده دارند.
مشکلات و عوارض جانبی
عصبی
یک پیامد رایج در بزرگسالان تحت درمان با ECMO آسیب عصبی است که ممکن است شامل خونریزی داخل مغزی، خونریزی زیر عنکبوتیه، انفارکتوس ایسکمیک در نواحی حساس مغز، انسفالوپاتی هیپوکسیک-ایسکمیک، کمای غیر قابل توضیح و مرگ مغزی باشد. خونریزی در 30 تا 40 درصد از افرادی که ECMO دریافت می کنند رخ می دهد و می تواند تهدید کننده زندگی باشد. این هم به دلیل تزریق مداوم هپارین ،که ضروری است، و هم به دلیل اختلال عملکرد پلاکتی می باشد. تکنیک جراحی دقیق، حفظ تعداد پلاکتها بیش از 100000 در میلیمتر مکعب، و حفظ زمان لخته شدن فعال شده، احتمال خونریزی را کاهش میدهد.
خون
ترومبوسیتوپنی ناشی از هپارین (HIT) به طور فزاینده ای در بین افرادی که ECMO دریافت می کنند دیده می شود. هنگامی که به HIT مشکوک باشید،توصیه می شود بجای تزریق هپارین از یک ضد انعقاد دیگر استفاده شود.
هر زمان که شریان و ورید فمورال برای ایکموی ونوآرتریال (وریدی شریانی) استفاده می شود، جریان خون رتروگراد در آئورت نزولی اتفاق می افتد.اگر برون ده بطن چپ حفظ نشود، ممکن است استاز خون رخ دهد که نتیجه آن بروز ترومبوز است.
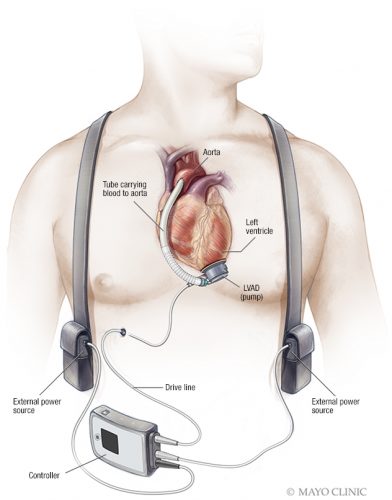
دستگاه پلی بسوی حمایت(Bridge-to-assist device)
دستگاه پلی بسوی حمایت(Bridge-to-assist device)
در VA ECMO، کسانی که عملکرد قلبی آنها به اندازه کافی بهبود نمی یابد تا از ECMO جدا شوند، ممکن است به یک دستگاه کمک بطنی (VAD) یا حتی پیوند عضو نیازمند شوند. عوارض مختلفی در حین کانولاسیون ممکن است رخ دهد، از جمله سوراخ شدن رگ همراه با خونریزی، دیسکسیون شریانی، ایسکمی دیستال و جایگیری نامناسب.
کودکان
اگر ECMO در سن حاملگی کمتر از 32 هفته انجام شود، نوزادان نارس که دچار نارسایی قلبی و ریوی هستند، در معرض خطر اجتناب ناپذیر برای خونریزی داخل بطنی (IVH) می باشند.
عفونت ها
شیوع عفونت های بیمارستانی در طی انجام ایکمو(ECMO) 10-12٪ است (خیلی بیشتر از سایر بیماران بدحال). استافیلوکوک های کواگولاز منفی، گونه های کاندیدا، انتروباکتریاسه و سودوموناس آئروژینوزا شایع ترین پاتوژن های درگیر هستند. بیماران ECMO بروز بالایی از پنومونی مرتبط با ونتیلاتور را دارند (24.4 مورد در 1000 روز ECMO)، که عامل اصلی آن Enterobacteriaceae می باشد. دیده اند که خطر عفونت همراه با مدت اجرای ECMO افزایش می یابد؛زمان، مهمترین عامل خطر برای ایجاد عفونت است. سایر عوامل اختصاصی ECMO که بیمار را مستعد ابتلا به عفونت می نماید عبارتند از: شدت ناخوشی در بیماران ECMO، خطر بالای انتقال باکتری از دستگاه گوارش و اختلال سیستم ایمنی ناشی از ECMO . موضوع مهم دیگر، کلونیزاسیون میکروبی کاتترها، کانولهای ECMO و دستگاه اکسیژن ساز است.
ایکموی وریدی وریدی و شریانی وریدی
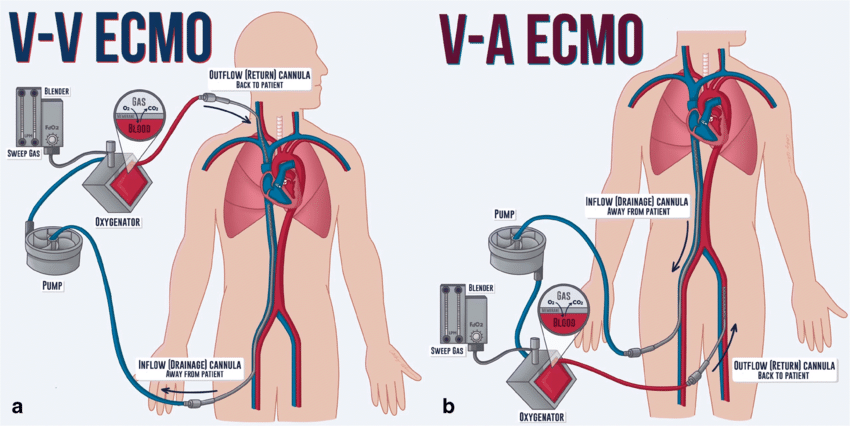
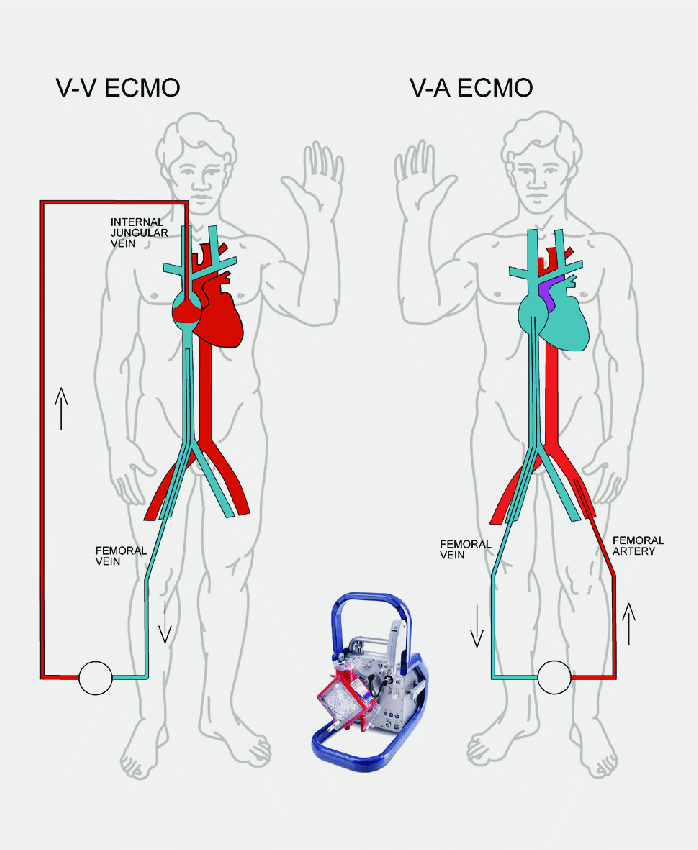
انواع
اشکال مختلفی از ECMO وجود دارد. دو مورد از رایج ترین آنها ECMO وریدی- شریانی (VA) و ECMO وریدی-وریدی (VV) است. در هر دو روش، خون خارج شده از سیستم وریدی بدن، در خارج از بدن اکسیژن میگیرد. در VA ECMO این خون به سیستم شریانی و در VV ECMO خون به سیستم وریدی باز می گردد. در VV ECMO نیازی به هیچ حمایت قلبی نیست.
وریدی – شریانی
در ECMO شریان وریدی (VA)، یک کانول وریدی معمولاً در ورید فمورال مشترک راست یا چپ برای استخراج (خون) قرار میگیرد، و یک کانول شریانی برای انفوزیون معمولا در شریان فمورال راست یا چپ قرار میگیرد.نوک کانول ورید فمورال باید در نزدیکی محل اتصال ورید اجوف تحتانی و دهلیز راست نگه داشته شود، در حالی که نوک کانول شریانی فمورال در شریان ایلیاک قرار دارد.در بزرگسالان، دسترسی به شریان فمورال ترجیح داده می شود، زیرا قرار دادن آن ساده تر است.اگر بای پس قلبی ریوی قبلا ایجاد شده یا استرنوتومی مجدد بطور اورژانسی (با قرار دادن کانول در دهلیز راست (یا SVC/IVC برای ترمیم تریکوسپید) و آئورت صعودی صورت گرفته شده باشد، می توان از VA ECMO مرکزی استفاده کرد.
VA ECMO معمولاً برای زمانی بکار گرفته میشود که عملکرد قلبی آنقدر کافی نیست که بتواند افزایش کار ضربه قلبی مرتبط با پمپاژ در برابر جریان رتروگراد ارسال شده توسط کانولای آئورت، را تحمل کند.
وریدی-وریدی
در ECMO وریدی-وریدی (VV)، کانول ها معمولاً در ورید مشترک فمورال سمت راست برای تخلیه و ورید ژوگولار داخلی راست برای انفوزیون قرار می گیرند.روش دیگر، یک کاتتر دو لومن در ورید ژوگولار داخلی سمت راست قرار داده می شود و خون را از ورید اجوف فوقانی و تحتانی تخلیه می کند و آن را به دهلیز راست باز می گرداند.
شروع
ECMO باید فقط توسط پزشکانی که آموزش و تجربه در شروع، نگهداری و قطع آن دارند، انجام شود. قرار دادن ECMO معمولاً در اتاق عمل توسط جراح قلب انجام می شود. مدیریت ECMO معمولاً توسط یک پرستار مجرب، درمانگر تنفسی یا یک متخصص پرفیوژن انجام می شود. هنگامی که تصمیم به شروع ECMO گرفته شد، بیمار تحت درمان با هپارین وریدی قرار می گیرد تا از تشکیل ترومبوز ناشی از لخته شدن خون در دستگاه اکسیژن ساز جلوگیری شود. قبل از شروع، یک بولوس وریدی هپارین داده شده واطمینان حاصل شود که زمان لخته شدن فعال (ACT) بین 300 تا 350 ثانیه باشد. هنگامی که ACT بین این محدوده قرار گرفت، می توان ECMO را شروع کرد و تجویز هپارین را با دوز نگهدارنده شروع کرد.
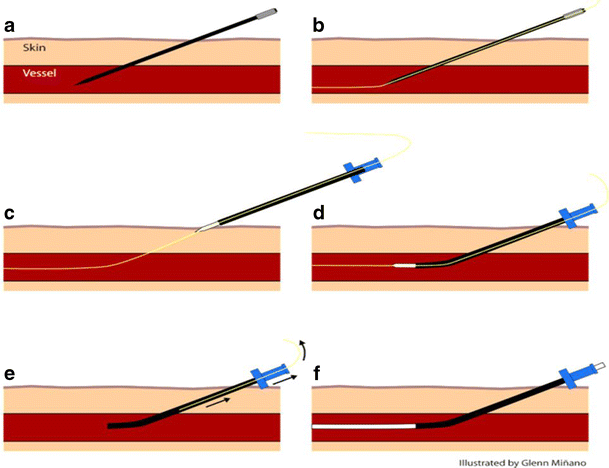
مراحل قدم به قدم روش سلدینگر
کانولاسیون
کانول ها را می توان از طریق پوست با تکنیک سلدینگر، روشی نسبتاً ساده و رایج برای دستیابی به رگ های خونی، یا از طریق برش جراحی قرار داد. از بزرگترین کانول هایی که می توان در عروق قرار داد به منظور به حداکثر رساندن جریان و به حداقل رساندن تنش برشی استفاده می شود. با این حال، ایسکمی اندام یکی از عوارض بدنام ECMO است، اما می توان با استفاده از روش مناسب پرفیوژن دیستال اندام از آن جلوگیری کرد.علاوه بر این،از ECMO می توان در حین عمل در طول پیوند ریه برای تثبیت بیمار با نتایج عالی استفاده شود.
ECMO مورد نیاز برای عوارض بعد از جراحی قلب را می توان مستقیماً در حفره مناسب قلب یا عروق بزرگ قرار داد. کانولاسیون محیطی (فمورال یا ژوگولار) می تواند به بیمارانی که در انتظار پیوند ریه هستند این امکان را بدهد که بیدار و سرپا با نتایج مطلوب پس از پیوند باقی بمانند.
تیتراسیون
پس از کانولاسیون و اتصال به مدار ECMO، مقدار مناسب جریان خون در مدار ECMO با استفاده از پارامترهای همودینامیک و معاینه فیزیکی تعیین می شود. اهداف حفظ خونرسانی اندام انتهایی از طریق مدار ECMO ، به کمک جریان خون فیزیولوژیک کافی در قلب به منظور جلوگیری از استاز و تشکیل لخته خون متوازن می گردد.
نگهداری
هنگامی که اهداف اولیه تنفسی و همودینامیک به دست آمد، جریان خون با همان سرعت حفظ می شود. ارزیابی و تنظیم مکرر توسط اکسیمتری وریدی پیوسته، که به طور مستقیم اشباع اکسی هموگلوبین خون در اندام وریدی مدار ECMO را اندازه گیری می کند،صورت می گیرد.
ملاحظات خاص
VV ECMO معمولاً برای نارسایی تنفسی ، ولی VA ECMO برای نارسایی قلبی استفاده می شود. ملاحظات منحصر به فردی برای هر نوع ECMO وجود دارد که بر مدیریت تأثیر می گذارد.
جریان خون
سرعت جریان بالا معمولاً در طی VV ECMO برای بهینهسازی اکسیژن رسانی مورد نظر است. در مقابل، سرعت جریان مورد استفاده در طی VA ECMO باید به قدری بالا باشد تا فشار پرفیوژن کافی و اشباع اکسی هموگلوبین وریدی (اندازهگیری شده در خون خروجی) را فراهم کند، اما به اندازه کافی کم باشد تا پیش بار کافی برای حفظ برون ده بطن چپ را فراهم کند.
دیورز
از آنجایی که اکثر افراد هنگام شروع ECMO دچار اضافه بار مایعات می شوند، پس از اینکه بیمار در ECMO به وضعیت پایداری برسد، دیورز تهاجمی ضروری است. اگر برونده ادرار بیمار ناکافی باشد، می توان به راحتی اولترافیلتراسیون را به مدار ECMO اضافه کرد. ECMO “نامتوازن”، یا ناپایداری شکل موج ECMO، نشان دهنده احیای کم است ، بنابراین توصیه به توقف دیورز تهاجمی یا اولترافیلتراسیون می شود. خطر آسیب حاد کلیه مربوط به استفاده از ECMO و پاسخ التهابی سیستمیک افزایش می یابد.
مانیتورینگ بطن چپ
برون ده بطن چپ به شدت در طول VA ECMO کنترل می شود زیرا عملکرد بطن چپ می تواند به دلیل افزایش بار اضافی مختل شود که به نوبه خود می تواند منجر به تشکیل ترومبوز در قلب شود.
جداسازی و قطع کردن
برای افرادی که دچار نارسایی تنفسی هستند، بهبود در ظاهر رادیوگرافیک، کمپلیانس ریوی و اشباع اکسی هموگلوبین شریانی نشان دهنده آن است که فرد آماده قطع پشتیبانی ECMO می باشد. برای افرادی که دچار نارسایی قلبی هستند، افزایش ضربان آئورت با بهبود برون ده بطن چپ مرتبط است و نشان می دهد که احتمالا بیمار آماده حذف پشتیبانی ECMO باشد. اگر همه مارکرها در وضعیت خوبی باشند، جریان خون در ECMO به آرامی کاهش مییابد و علائم حیاتی بیمار تحت کنترل قرار میگیرد تا اطمینان حاصل شود که بیمارتوانسته تغییرات را تحمل کند. هنگامی که جریان خون کمتر از 2 لیتر در دقیقه است، اقدام به برداشتن دائمی می شود و بیمار در این مدت تحت نظر قرار می گیرد تا کانول ها نیز برداشته شوند.
اقدام به آزادسازی ECMO وریدی-وریدی
سعی بر جداسازی VV ECMO با حذف تمام گازهای جریان مخالف از طریق دستگاه اکسیژن ساز انجام می شود. جریان خون خارج از بدن ثابت مانده، اما انتقال گاز صورت نمی گیرد. سپس بیمار برای چندین ساعت تحت نظر قرار گرفته می شود، که در طی آن ونتیلاتور، به منظور حفظ اکسیژن کافی و تهویه در خارج از ECMO، همانطور که توسط نتایج گاز خون شریانی و وریدی نشان داده می شود،تنظیم می شود.
اقدام آزادسازی ECMO شریانی وریدی
سعی برجداسازی VA ECMO نیاز به بستن موقت مسیر های عروقی و انفوزیون دارند، در حالی که به مدار ECMO اجازه می دهد تا از طریق یک پل بین اندام های شریانی و وریدی گردش کند، بدینگونه از ترومبوز خون راکد در مدار ECMO جلوگیری می شود. علاوه بر این،مسیرهای شریانی و وریدی باید به طور مداوم با سالین هپارینه شده یا به طور متناوب با خون هپارینه شده از مدار شسته شوند. به طور کلی، اقدام به جداسازی در روش VA ECMO در مقایسه با VV ECMO کوتاهتر هستند زیرا خطر تشکیل ترومبوز بالاتر است.
تاریخ
ECMO در دهه 1950 توسط John Gibbon و سپس C. Walton Lillehei توسعه یافت. اولین استفاده برای نوزادان در سال 1965 بود.
بانینگ گری لری (Banning Gray Lary) اولین فردی بود که نشان داد که اکسیژن داخل وریدی می تواند زندگی را حفظ کند. نتایج او در نوامبر 1951 در نشریه انجمن جراحی منتشر شد. لاری در سال 2007 درباره کار اولیه خود اظهار داشت: “تحقیق ما با مونتاژ دستگاهی شروع شد که برای اولین بار حیوانات را در حین تنفس نیتروژن خالص زنده نگه میداشت. این کار با تزریق حبابهای بسیار کوچک اکسیژن به خون انجام شد. این حباب ها با افزودن یک عامل مرطوب کننده به اکسیژن تولید شده اند که از طریق فیلتر چینی به جریان خون وریدی وارد می شود. اندکی پس از ارائه اولیه آن به کالج جراحان آمریکا، این دستگاه توسط والتون لیلهی (Walton Lillehei) و به کمک دوال( DeWall)، مورد بررسی قرار گرفت. این دو،اولین دستگاه عملی قلب ریه را که از اکسیژن ساز حباب دار استفاده می کرد، تولید کردند. این دستگاه برای چندین دهه با اندکی تغییرات مورد استفاده دیگران قرار گرفت.